Обновлено: 02.05.2023
ММА имени И.М. Сеченова
Б олезнь Грейвса (болезнь Базедова, диффузный токсический зоб, БГ) — системное аутоиммунное заболевание, развивающееся вследствие выработки антител к рецептору тиреоторопного гормона (ТТГ), клинически проявляющееся поражением щитовидной железы (ЩЖ) с развитием синдрома тиреотоксикоза в сочетании с экстратиреоидной патологией (эндокринная офтальмопатия, претибиальная микседема, акропатия). Одновременное сочетание всех компонентов системного аутоиммунного процесса встречается относительно редко и не является облигатным для постановки диагноза. В большинстве случаев наибольшее клиническое значение при БГ имеет поражение ЩЖ.
В США и Англии частота новых случаев БГ варьирует от 30 до 200 случае на 100 тысяч населения в год. Женщины заболевают БГ в 10-20 раз чаще. В регионах с нормальным йодным обеспечением болезнь Грейвса является наиболее частой причиной стойкого тиреотоксикоза, а в йододефицитных регионах в этиологической структуре токсического зоба БГ конкурирует с функциональной автономией ЩЖ (узловой и многоузловой токсический зоб). В России в качестве синонима термина болезнь Грейвса (болезнь Базедова) традиционно используется термин диффузный токсический зоб, который не лишен ряда существенных недостатков. Во-первых, он характеризует лишь макроскопическое (диффузный зоб) и функциональное (токсический) изменение ЩЖ, которое не является облигатным для болезни Грейвса: с одной стороны, увеличения железы может не быть, с другой — он может быть не диффузным. Вместе с тем, диффузное увеличение ЩЖ в сочетании с тиреотоксикозом может иметь место при других заболеваниях, в частности, при так называемой диффузной функциональной автономии. Использование более широкого термина «болезнь» (а не просто токсический зоб) применительно к обсуждаемому заболеванию, скорее всего, более оправдано, поскольку он в большей мере подчеркивает системность аутоиммунного процесса. Кроме того, во всем мире традиционно наиболее часто используется и, таким образом, узнается именно термин болезнь Грейвса, а в немецко-говорящих странах — болезнь Базедова.
БГ является мультифакториальным заболеванием, при котором генетические особенности иммунного реагирования реализуются на фоне действия факторов окружающей среды. Наряду с этнически ассоциированной генетической предрасположенностью (носительство гаплотипов HLA-B8, -DR3 и -DQA1*0501 у европейцев) в патогенезе БГ определенное значение придается психосоциальным и средовым факторам. Так, уже достаточно давно обсуждается значение инфекционных и стрессорных факторов, в частности, ряд работ выдвигает теорию «молекулярной мимикрии» между антигенами ЩЖ, ретробульбарной клетчатки и рядом стресс-протеинов и антигенов бактерий (Yersinia enterocolitica). Эмоциональные стрессорные и экзогенные факторы, такие как курение, могут способствовать реализации генетической предрасположенности к БГ. Так, была обнаружена временная взаимосвязь между манифестацией БГ и потерей супруга (партнера). Курение повышает риск развития БГ в 1,9 раз.
БГ в ряде случаев сочетается с другими аутоиммунными эндокринными заболеваниями (сахарный диабет 1 типа, первичный гипокортицизм); такое сочетание принято обозначать, как аутоиммунный полигландулярный синдром II типа.
В результате нарушения иммунологической толерантности, аутореактивные лимфоциты (CD4 + — и CD8 + -T-лимфоциты, B-лимфоциты) опосредованно адгезивными молекулами (ICAM-1, ICAM-2, E-селектин, VCAM-1, LFA-1, LFA-3, CD44) инфильтрируют паренхиму ЩЖ, где распознают ряд антигенов, которые презентируются дендридными клетками, макрофагами, В-лимфоцитами и HLA-DR-экспримирующими фолликулярными клеткам. В дальнейшем цитокины и сигнальные молекулы инициируют антигенспецифическую стимуляцию В-лимфоцитов, в результате чего начинается продукция специфических иммуноглобулинов против различных компонентов тироцитов. В патогенезе БГ основное значение придается образованию стимулирующих антител к рецептору ТТГ (АТ-рТТГ). Эти антитела связываются с рецептором ТТГ, приводят его в активное состояние, запуская внутриклеточные системы (каскады цАМФ и фосфоинозитолов), которые стимулируют захват ЩЖ йода, синтез и высвобождение тиреоидных гормонов, а также пролиферацию тироцитов. В результате развивается синдром тиреотоксикоза, доминирующий в клинической картине БГ.
Клиническая картина
Классическая мерзебургская триада (зоб, тахикардия, экзофтальм), описанная еще Карлом Базедовым, встречается примерно у 50% пациентов. Примерно в 2/3 случаев БГ развивается в возрасте после 30 лет, не менее, чем в 5 раз чаще — у женщин. В отдельных популяциях (Япония, Швеция) БГ почти в половине случаев манифестирует на протяжении первого года после родов.
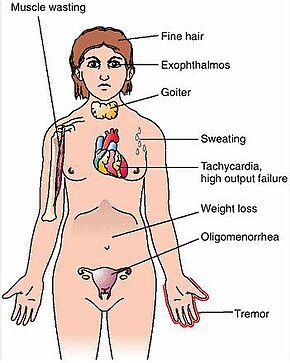
Как указывалось, клиническая картина БГ определяется синдромом тиреотоксикоза, для которого характерны: похудение (часто на фоне повышенного аппетита), потливость, тахикардия и ощущение сердцебиения, внутреннее беспокойство, нервозность, дрожь рук (а порой, всего тела), общая и мышечная слабость, быстрая утомляемость и ряд других симптомов, подробно описанных в литературе. В отличие от многоузлового токсического зоба, который связан с функциональной автономией ЩЖ, при БГ, как правило, имеет место короткий анамнез: симптомы развиваются и прогрессируют быстро и в большинстве случаев приводят пациента к врачу в пределах 6-12 месяцев. У пожилых пациентов тиреотоксикоз любого генеза часто протекает олиго- или моносимптомно (вечерний субфебрилитет, аритмии) или даже атипично (анорексия, неврологическая симптоматика). При пальпаторном исследовании примерно у 80% пациентов удается выявить увеличение ЩЖ, порой весьма значительное: пальпаторно железа плотноватая, безболезненная.
В ряде случаев, при БГ на первое место могут выходить проявления эндокринной офтальмопатии (выраженный экзофтальм, нередко имеющий несимметричный характер, диплопия при взгляде в одну из сторон или вверх, слезотечение, ощущение «песка в глазах», отечность век). Здесь следует оговориться, что наличие у пациента выраженной эндокринной офтальмопатии (ЭОП) позволяет практически безошибочно установить пациенту этиологический диагноз уже по клинической картине, поскольку среди заболеваний, протекающих с тиреотоксикозом, ЭОП сочетается только с БГ.
Диагностика
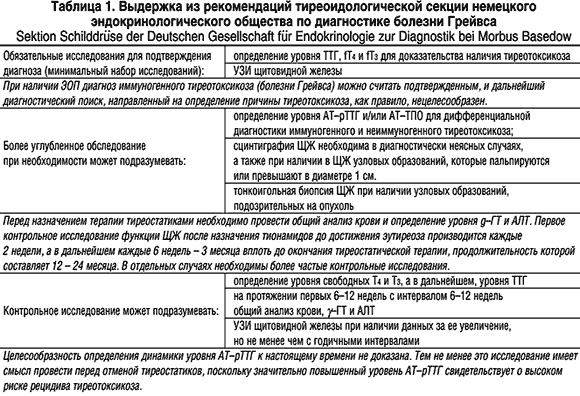
Диагностика в типичных случаях не вызывает существенных трудностей (табл. 1). При подозрении на наличие у пациента тиреотоксикоза ему показано определение уровня ТТГ высокочувствительным методом (функциональная чувствительность не менее 0,01 мЕд/л). При обнаружении пониженного уровня ТТГ пациенту проводится определение уровня свободных Т4 и Т3: если хотя бы один из них повышен — речь идет о манифестном тиреотоксикоза, если они оба в норме — о субклиническом.
После подтверждения наличия у пациента тиреотоксикоза проводится этиологическая диагностика, направленная на выявление конкретного заболевания, которое его обусловило. При УЗИ примерно в 80% случаев БГ обнаруживается диффузное увеличение ЩЖ; кроме того, этот метод может выявить характерную для большинства аутоиммунных заболевания гипоэхогенность ЩЖ. По данным сцинтиграфии при БГ выявляется диффузное усиление захвата изотопа железой. Как и при всех других аутоиммунных заболеваниях ЩЖ, при БГ могут определяться высокие уровни классических антител к ЩЖ (антитела к тиреоидной пероксидазе — АТ-ТПО и антитела к тиреоглобулину — АТ-ТГ). Это наблюдается не менее чем в 70-80% случаев БГ. Таким образом, обнаружение классических антител не позволяет отличить БГ от хронического аутоиммунного, послеродового и «безболевого» («молчащего») тиреоидита, но может, в сумме с другими признаками, существенно помочь в дифференциальной диагностике БГ и функциональной автономии ЩЖ. Следует помнить о том, что классические антитела могут обнаруживаться у здоровых людей без каких-либо заболеваний ЩЖ. Большее диагностическое значение имеет определение уровня антител к рецептору ТТГ (АТ-рТТГ), которое, увы, пока не абсолютно из-за несовершенства имеющихся тестсистем. В таблице 2 представлена краткая характеристика других заболеваний, протекающих с тиреотоксикозом, с которыми необходимо дифференцировать БГ.
Прежде всего, планируя лечение, нужно отчетливо понимать, что при БГ речь идет об аутоиммунном заболевании, причиной которого является выработка антител к ЩЖ иммунной системой. Вопреки этому, к сожалению, очень часто приходится сталкиваться с представлением о том, что хирургическое удаление части ЩЖ само по себе способно вызвать ремиссию заболевания (т.е., по сути, аутоиммунного процесса), хотя как хирургия БГ, так и терапия радиоактивным йодом-131 идеологически должна восприниматься, лишь как удаление из организма «органа-мишени» для антител, ликвидирующее тиреотоксикоз. В настоящее время существует 3 метода лечения БГ, каждый из которых не лишен существенных недостатков.
Прежде всего, планируя лечение, нужно отчетливо понимать, что при БГ речь идет об аутоиммунном заболевании, причиной которого является выработка антител к ЩЖ иммунной системой. Вопреки этому, к сожалению, очень часто приходится сталкиваться с представлением о том, что хирургическое удаление части ЩЖ само по себе способно вызвать ремиссию заболевания (т.е., по сути, аутоиммунного процесса), хотя как хирургия БГ, так и терапия радиоактивным йодом-131 идеологически должна восприниматься, лишь как удаление из организма «органа-мишени» для антител, ликвидирующее тиреотоксикоз. В настоящее время существует 3 метода лечения БГ, каждый из которых не лишен существенных недостатков.
Консервативное лечение болезни Грейвса
Назначается для достижения эутиреоза перед оперативным лечением, а также в отдельных группах пациентов в качестве базового длительного курса лечения, который в некоторых случаях приводит к стойкой ремиссии. Длительную консервативную терапию имеет смысл планировать далеко не у всех пациентов. В первую очередь, речь идет о пациентах с умеренным увеличением объема ЩЖ (до 40 мл); при зобе больших размеров после отмены тиреостатиков неминуемо разовьется тиреотоксикоз. Кроме того, консервативную терапию нецелесообразно планировать у пациентов с крупными (более 1-1,5 см) узловыми образованиями в ЩЖ и при наличии выраженных осложнений тиреотоксикоза (мерцательная аритмия, выраженный остеопороз и др.). Практически бессмысленно (и главное — небезопасно для пациента) назначение повторных курсов лечения при развитии рецидива тиреотоксикоза спустя 12-24 месяца тиреостатической терапии. Важным условием планирования длительной тиростатической терапии является готовность пациента следовать рекомендациям врача (комплаентность) и доступность квалифицированной эндокринологической помощи.
В качестве основных тиреостатиков на протяжении многих десятилетий в клинической практике во всем мире используются препараты из группы тионамидов: тиамазол (Метизол) и пропилтиоурацил. Ключевой механизм действия тионамидов заключается в том, что, попадая в ЩЖ, они подавляют действие тиреоидной пероксидазы, ингибируют окисление йода, йодирование тиреоглобулина и конденсацию йодтирозинов. В результате прекращается синтез тиреоидных гормонов и купируется тиреотоксикоз. Наряду с этим выдвигается не всеми поддерживаемая гипотеза о том, что тионамиды, в первую очередь, тиамазол, обладают эффектами на иммунологические изменения, развивающиеся при БГ. В частности, предполагается, что тионамиды влияют на активность и количество некоторых субпопуляций лимфоцитов, снижают иммуногенность тиреоглобулина за счет уменьшения его йодирования, снижают продукцию простагландинов Е2, IL-1, IL-6 и продукцию тироцитами белков теплового шока. Именно с этим связывается тот факт, что в правильно отобранной группе пациентов с БГ, на фоне подержания тионамидами эутироза в течение 12-24 месяцев примерно в 30% случаев можно ожидать развития стойкой ремиссии заболевания.
Если пациенту планируется проведение курса тиростатической терапии, тионамиды в начале назначаются в относительно больших дозах: 30-40 мг тиамазола (на 2 приема) или пропилтиоурацила — 300 мг (на 3-4 приема). На фоне такой терапии спустя 4-6 недель у 90% пациентов с тиреотоксикозом средней тяжести удается достичь эутиреоидного состояния, первым признаком которого является нормализация уровня свободного Т4. Уровень ТТГ может еще долго оставаться сниженным. На период до достижения эутиреоза (зачастую и на более длительный срок) большинству пациентов целесообразно назначение b -адреноблокаторов (пропранолол — 120 мг/сут на 3-4 приема или длительнодействующие препараты, например, атенолол — 100 мг/сут однократно). От «увлечения» малыми стартовыми дозами тиамазола, когда исходно предлагалось назначать 10-15 мг препарата в день, в последнее десятилетие большинство руководств отошли, поскольку при таком варианте терапии достижение эутиреоза растягивается на слишком большой промежуток времени, что клинически не выгодно, зачастую небезопасно и не исключает риска лейкопенических реакций. В то же время от небезопасного назначения мегадоз тиамазола в качестве стартовой терапии (80-120 мг) также отошли за исключением случаев тяжелейшего тиреотоксикоза.
После нормализации уровня свободного Т4 пациенту начинают снижать дозу тиреостатика и примерно через 2-3 недели переходят на прием поддерживающей дозы (10-15 мг в день). Параллельно, начиная от момента нормализации уровня Т4 или несколько позже, пациенту назначается левотироксин в дозе 50-100 мкг в день. Такая схема получила название «блокируй и замещай»: один препарат блокирует железу, другой замещает формирующийся дефицит тиреоидных гормонов. Схема «блокируй и замещай» проста в использовании, поскольку позволяет полностью заблокировать продукцию тиреоидных гормонов, что исключает возможность возвращений тиреотоксикоза. Критерием адекватности терапии является стойкое поддержание нормального уровня Т4 и ТТГ (последний может приходить в норму на протяжении нескольких месяцев от начала лечения). Вопреки бытующим представлениям тиамазол и пропилтиоурацил сами по себе не обладают так называемым «зобогенным» эффектом. Увеличение размера ЩЖ на фоне их приема закономерно развивается лишь при развитии медикаментозного гипотиреоза, которого можно легко избежать, назначив левотироксин в рамках схемы «блокируй и замещай».
Поддерживающая терапия «блокируй и замещай» (10-15 мг тиамазола и 50-100 мкг левотироксина) продолжается от 12 до максимум 24 месяцев (табл. 1). Дальнейшее увеличение объема ЩЖ на фоне проводимой терапии даже при условии стойкого поддержания эутиреоза (это закономерно произойдет при медикаментозном гипотиреозе или, наоборот, при недостаточной блокаде ЩЖ) существенно снижает шансы на успех лечения. На протяжении всего лечения у пациента с интервалом не менее чем 1 раз в месяц необходимо проводить определение уровня лейкоцитов и тромбоцитов. Редким (0,06%), но грозным осложнением тионамидов (как тиамазола, так, с практически одинаковой частотой пропилтиоурацила) является агранулоцитоз, казуистически редко — изолированная тромбоцитопения. После окончания курса лечения препараты отменяются; наиболее часто рецидив развивается в течение первого года после прекращения терапии.
Оперативное лечение
По современным представлениям, целью оперативного лечения, равно как и обсуждаемой ниже терапии йодом-131, является удаление большей части ЩЖ, с одной стороны, обеспечивающее развитие послеоперационного гипотиреоза, а с другой (что наиболее принципиально) — исключающее любую возможность рецидива тиреотоксикоза. С этой целью рекомендуется проведение предельно субтотальной резекции ЩЖ с оставлением тиреоидного остатка не более 2-3 мл. Проведение субтотальных резекций, с одной стороны, несет высокий риск сохранения или отдаленного рецидива тиреотоксикоза, а с другой, отнюдь не исключает развития гипотиреоза. При выполнении так называемых «экономных резекций», объем которых во всем мире расцениваются, как неадекватный, следует понимать, что оставляя во время операции достаточную для продукции тиреоидных гормонов часть ЩЖ, в организме, по сути дела, остается «мишень» для антитиреоидных антител, продуцирующихся клетками иммунной системы.
Таким образом, полеоперационный гипотиреоз в настоящее время перестал рассматриваться, как осложнение оперативного лечения БГ, и является его целью. Предпосылкой для этого стало внедрение в широкую клиническую практику современных препаратов левотироксина, на фоне адекватного приема которых у пациента сохраняется стойкий эутиреоз и качество жизни, не отличающееся от обычного. На сегодняшний день можно без преувеличения сказать, что не существует такого гипотиреоза, компенсация которого при грамотном использовании современных препаратов тиреоидных гормонов была бы невозможна. Неудачи в лечении послеоперационного и любого другого гипотиреоза следует искать либо в недостаточной квалификации проводящего заместительную терапию, либо в несоблюдении пациентом достаточно простых рекомендаций по приему препарата.
Терапия радиоактивным йодом
Можно без преувеличения сказать, что во всем мире большая часть пациентов с БГ, равно как и с другими формами токсического зоба, в качестве лечения получает именно терапию радиоактивным йодом-131. Это связано с тем, что метод эффективен, неинвазивен, относительно дешев, лишен тех осложнений, которые могут развиться во время операции на ЩЖ. Единственными противопоказаниями к лечению йодом-131 являются беременность и грудное вскармливание.
Если в нашей стране по сей день продолжает бытовать мнение о том, что терапия йодом-131 показана лишь пожилым пациентам, которым по тем или иным причинам невозможно провести операцию, то на самом деле, уже не существует нижней возрастной границы для назначения йода-131, и во многих странах йод-131 с успехом используется для лечения БГ у детей. Было доказано, что независимо от возраста риск терапии йодом-131 существенно ниже такового при оперативном лечении.
В значимых количествах йод-131 накапливается только в ЩЖ; после попадания в нее, он начинает распадаться с выделением b -частиц, которые имеют длину пробега около 1-1,5 мм, что обеспечивает локальную лучевую деструкцию тироцитов. Безопасность этого метода лечения демонстрирует тот факт, что в ряде стран, например, в США, где 99% пациентов с БГ получают йод-131 в качестве лечения первого выбора, терапия йодом-131 при БГ осуществляется в амбулаторном порядке. Существенное преимущество заключается в том, что лечение йодом-131 можно проводить без предварительной подготовки тионамидами. При болезни БГ, когда целью лечения является разрушение ЩЖ, терапевтическая активность, с учетом объема ЩЖ, максимального захвата и времени полувыведения йода-131 из ЩЖ, рассчитывается исходя из предполагаемой поглощенной дозы в 200-300 Гр. Гипотиреоз обычно развивается в течение 6 месяцев после введения йода-131.
Серьезной проблемой отечественной эндокринологии является фактическое отсутствие в распоряжении эндокринологов такого прекрасного способа лечения БГ, как терапия йодом-131.
Заключение
БГ является одним из самых частых аутоиммунных заболеваний человека. Его клиническая картина и прогноз в большинстве случаев определяются стойким тиреотоксикозом, который при отсутствии адекватного лечения может привести к тяжелой инвалидизации пациента. Существующие на сегодняшний день принципы лечения БГ, хотя и не лишены недостатков, но позволяют полностью избавить пациента от тиреотоксикоза и обеспечить приемлемое качество жизни.
Болезнь Грейвса
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Для корректной оценки результатов ваших анализов в динамике предпочтительно делать исследования в одной и той же лаборатории, так как в разных лабораториях для выполнения одноименных анализов могут применяться разные методы исследования и единицы измерения.
Болезнь Грейвса: причины появления, симптомы, диагностика и способы лечения.
Определение
Болезнь Грейвса (другие названия — Базедова болезнь, токсический зоб) — наследственное аутоиммунное заболевание, которое может развиться в любом возрасте. Женщины болеют примерно в 5 раз чаще, чем мужчины. Болезнь характеризуется избыточной выработкой тиреоидных гормонов, что приводит к тиреотоксикозу (избытку гормонов щитовидной железы в кровеносном русле).
Замечено, что патологический процесс часто запускается в ситуациях, когда организм испытывает стресс.
Причины появления болезни Грейвса
Болезнь Грейвса связывают с врожденным дефектом специфических Т-лимфоцитов (в организме Т-лимфоциты регулируют скорость защитной реакции, ее продолжительность, обеспечивают клеточный иммунитет). Вследствие срыва иммунологической толерантности происходит активация В-лимфоцитов, продуцирующих тиреостимулирующие иммуноглобулины — АТ-рТТГ. АТ-рТТГ воздействуют на рецепторы к ТТГ и начинают стимулировать клетки щитовидной железы. Это приводит к выраженному повышению выработки тиреоидных гормонов (Т4 и Т3), а также к увеличению щитовидной железы в размерах (гипертрофии).
Спусковым механизмом нарушения иммунологической толерантности может стать вирусная инфекция, стресс, курение.
При болезни Грейвса щитовидная железа может увеличиться до такой степени, что будет видна визуально. При отсутствии лечения она начинает сдавливать пищевод и трахею, вызывая нарушения глотания и дыхания.
Классификация заболевания
Классифицируется болезнь Грейвса по размеру зоба, а также по степени тяжести синдрома тиреотоксикоза.
В России до настоящего времени обычно используется классификация эндемического зоба по О.В. Николаеву, предложенная еще в 1955 году.
0-я степень — щитовидная железа не видна и не пальпируется;
1-я степень — щитовидная железа не видна, но пальпируется и виден при глотании перешеек;
2-я степень — щитовидная железа видна во время глотания, пальпируется, форма шеи не изменена;
3- я степень — щитовидная железа видна, меняется контур шеи («толстая шея»);
4-я степень — большой зоб, нарушающий конфигурацию шеи;
5-я степень — огромный зоб, сдавливающий пищевод и трахею.
Классификация по тяжести тиреотоксикоза
Субклинический период — заболевание устанавливается на основании данных гормонального исследования, клиническая картина может отсутствовать или быть стертой.
Манифестный период — присутствует развернутая клиническая картина заболевания.
Осложненный период — присутствуют осложнения (мерцательная аритмия, сердечная недостаточность, тирогенная относительная надпочечниковая недостаточность, дистрофические изменения паренхиматозных органов (печени, селезенки и т.д.), психоз, значительный дефицит массы тела).
Симптомы болезни Грейвса
Болезнь Грейвса отличается большим разнообразием клинических проявлений. Больные предъявляют жалобы на учащенное сердцебиение (тахикардию), аритмию, жар (непереносимость теплых и душных помещений), сильное потоотделение, ощущение внутренней дрожи, потерю массы тела при хорошем аппетите, частый неоформленный стул. Характерен подъем систолического («верхнего») давления и снижение диастолического (нижнего). Многие страдают из-за нарушения сна, быстрой утомляемости и снижения работоспособности. Отмечаются отеки ног, слабость мышц, неприятное чувство сжатости в области шеи.
Второе название заболевания — Базедова болезнь — свидетельствует о том, что у пациентов нередко регистрируются офтальмологические нарушения (эндокринная офтальмопатия), которые проявляются пучеглазием (поражением мягких тканей глазницы). Можно услышать жалобы на регулярное слезотечение, давление и «песок» в глазах, двоение, отечность век, светобоязнь.
При пальпаторном обследовании примерно у 80% пациентов удается выявить увеличенную щитовидную железу.
У пациентов репродуктивного возраста может наблюдаться снижение либидо (у мужчин), для женщин характерны нарушения менструального цикла.
Как правило, симптомы развиваются быстро, поэтому пациенты приходят на прием к врачу в течение 6-12 мес. после их манифестации.
Диагностика болезни Грейвса
При подозрении на наличие у пациента тиреотоксикоза следует исследовать уровень ТТГ высокочувствительным методом.
Отражает общее содержание гормона тироксина в крови — суммарный уровень свободной и связанной с белками фракциями. Синонимы: Анализ крови на общий тироксин. Th.
При пониженном показателе уровня ТТГ пациенту проводится определение уровня св. Т4 и св. Т3: если хотя бы один из них повышен — речь идет о манифестном тиреотоксикозе, если оба показателя в норме — о субклиническом.
Свободный, не связанный с транспортными белками плазмы крови тироксин. Синонимы: Анализ крови на свободный тироксин. Free T4; Free Form of Thyroxin. Краткая характеристика .
Синонимы: Свободный трийодтиронин. Free T3. Краткое описание исследуемого вещества Трийодтиронин свободный Трийодтиронин свободный (Т3св.) относится к тиреоидным .
В число обязательных входят анализы на антитела к тиреоидной пероксидазе и к тиреоглобулину.
Синонимы: Анализа крови на АТ-ТПО; Антитела к микросомальному антигену; АТПО. Antimicrosomal Antibodies; Antithyroid Microsomal Antibodies; Thyroid Peroxidase Autoantibodies; TPO Antibodies; Thyroid Peroxidase Test; Thyroid microsomal a.
Синонимы: Анализ крови на АТ-ТГ; Антитела к ТГ; АТТГ; АнтиТГ; Анти-ТГ. Tg Autoantibody; TgAb; Anti-Tg Ab; ATG. Краткое описание исследования «Антитела к тиреоглобулину&raq.
После подтверждения тиреотоксикоза проводится диагностика с целью выявления конкретного заболевания. Ультразвуковая картина болезни Грейвса не специфичная и характерна для других аутоиммунных заболеваний щитовидной железы. Кроме того, при болезни Грейвса могут определяться высокие уровни антитиреоидных антител — ат-ТПО и ат-ТГ. Однако вкупе с другими признаками заболевания и УЗИ, и анализ крови на ат-ТПО и ат-ТГ могут помочь в диагностике.
Исследование щитовидной и паращитовидных желез, позволяющее оценить их структуру, а также обнаружить патологические изменения этих органов и регионарных лимфоуз.
Большее диагностическое значение имеет определение уровня антител к рецепторам ТТГ (ат-рТТГ).
Синонимы: Анализ крови на антитела к рецепторам ТТГ; Ат-рТТГ; Аутоантитела к рецепторам тиреотропного гормона; Тиреоидстимулирующий иммуноглобулин; Анти-ТТГр. Thyroi.
К каким врачам обращаться
В связи патологическими состояниями, сопутствующими болезни Грейвса, пациенты (особенно пожилые) нередко находятся под наблюдением кардиологов, терапевтов, гастроэнтерологов, а к эндокринологам попадают только при нарастании клинической картины основного заболевания. Поэтому всех пациентов с впервые выявленной необъяснимой сердечной недостаточностью, мерцательной аритмией, синдромом хронической усталости необходимо обследовать по поводу тиреотоксикоза.
Лечение болезни Грейвса
Консервативная терапия
Консервативное лечение препаратами из группы тионамидов (препаратами, блокирующими выработку гормонов щитовидной железы) показано пациентам с умеренно увеличенным объемом щитовидной железы (до 40 мл) и без серьезных тиреотоксических осложнений. Если через 1-2 года после консервативной терапии произошел рецидив, назначать ее повторно не имеет смысла.
Радиотерапия
Терапия радиоактивным йодом выполняется с целью разрушения щитовидной железы. Метод неинвазивен, достаточно эффективен и лишен побочных эффектов, которые могут развиться после хирургической операции.
Оперативное лечение
Назначают пациентам в случае, если щитовидная железа имеет очень большие размеры, узлы или есть подозрение на их озлокачествление. Удаление щитовидной железы позволяет добиться послеоперационного гипотиреоза, который компенсируется за счет приема левотироксина и не приводит к снижению качества жизни пациентов.
Лечение эндокринной офтальмопатии
Рекомендуются глазные капли с дексаметазоном и ношение солнцезащитных очков.
Начиная со 2-й степени офтальмопатии пациентам назначают глюкокортикоиды. При резистентности к лечению или при рецидивах назначают рентгенотерапию на область орбиты. В сложных случаях прибегают к хирургической декомпрессии глазницы с удалением ретробульбарной клетчатки, а при необходимости — костных стенок глазницы. Косметические операции проводят, если требуется коррекция экзофтальма и косоглазия, развивающихся в результате фиброзных процессов.
Осложнения
Тиреотоксикоз негативно воздействует не только на щитовидную железу, но и на другие органы и системы. Чтобы избежать инвалидизации, требуется своевременное и правильное лечение.
Наиболее опасное осложнение болезни Грейвса — тиреотоксический криз. Он проявляется резким возбуждением, повышением температуры до 40 оС, сердцебиением до 200 ударов в минуту, усилением диспепсии (тошноты, рвоты, жажды). Затем могут появиться признаки надпочечниковой недостаточности (нарушение микроциркуляции, нитевидный пульс). Эта ситуация требует принятия срочных мер для снижения уровня тиреоглобулина и проявлений криза. Факторами развития тиреотоксического криза могут быть стресс, различные заболевания, избыточная физическая нагрузка, и т.д.
К осложнениям диффузного токсического зоба относятся осложнения после его хирургического лечения: гипопаратиреоз, повреждение возвратного гортанного нерва, в результате чего развивается осиплость голоса, кровотечения, аллергические реакции на препараты.
Профилактика болезни Грейвса
Прогноз при своевременной диагностике и надлежащем лечении благоприятный. Благодаря доступной заместительной терапии удается добиться нормализации метаболических процессов и исчезновения клинических проявлений заболевания.
Профилактикой диффузного токсического зоба является отказ от курения, приема лекарств, в побочных эффектах которых упоминается влияние на выработку тиреоидных гормонов, а также йод-содержащих препаратов, соблюдение оптимального режима дня для минимизации стрессовых ситуаций и регулярный контроль ТТГ.
- Федеральные клинические рекомендации по диагностике и лечению тиреотоксикоза с диффузным зобом (диффузный токсический зоб, болезнь Грейвса-Базедова), узловым/многоузловым зобом. Трошина Е.А., Свириденко Н.Ю., Ванушко В.Э и соавт. М. 2014.
- Клинические рекомендации «Диффузный токсический зоб». Дети. Разраб. Российская ассоциация эндокринологов. — 2021. — 35 с.
- Фадеев В.В. Диагностика и лечение болезни Грейвса. Медицинский совет, журнал. №4/2014. С. 44-48.
- Ванушко. В.Э., Фадеев В.В. Болезнь Грейвса (клиническая лекция). Эндокринная хирургия, журнал. №1/2013. С. 23-33.
Диффузный токсический зоб (Базедова болезнь, или болезнь Грейвса) — симптомы и лечение
Что такое диффузный токсический зоб (Базедова болезнь, или болезнь Грейвса)? Причины возникновения, диагностику и методы лечения разберем в статье доктора Родионова Е. А., терапевта со стажем в 14 лет.
Над статьей доктора Родионова Е. А. работали литературный редактор Елена Бережная , научный редактор Сергей Федосов
Определение болезни. Причины заболевания
Диффузный токсический зоб — это аутоиммунное поражение щитовидной железы.
Диффузный токсический зоб впервые был описан в трудах Роберта Джеймса Грейвса и Карла Адольфа фон Базедова в середине ХIХ века. Кроме данного заболевания, тиреотоксикоз может встречаться и при других заболеваниях щитовидной железы (тиреоидит, токсическая аденома и др.), что требует дифференциальной диагностики, так как лечение этих состояний не является однотипным, а осложнения из-за отсутствия или неправильного лечения могут привести к необратимым патологическим изменениям. [1] , [2]
В англоязычных странах это заболевание называют болезнью Грейвса, а немецкоязычных — Базедовой болезнью. Диффузный токсический зоб развивается из-за нарушенной функции СД8+-лимфоцитов и выработки антитиреоидных антител, среди которых особое значение придаётся тем, которые имеют сродство к рецепторам тиреотропного гормона в щитовидной железе. Эти антитела выявляются в среднем у 50% пациентов с диффузным токсическим зобом. С этими рецепторами в норме связывается тиреотропный гормон (ТТГ), что стимулирует выработку и выделение тиреоидных гормонов (ТГ). Антитела при связывании с рецепторами ТТГ увеличивают секрецию тироксина (Т4) и трийодтиронина (Т3) «в обход» регуляции ТТГ. Повышенный уровень тиреотропного гормона обуславливает развитие тиреотоксикоза. До конца не ясна причина такого дефекта иммунной системы. Имеются данные, позволяющие говорить о роли генетической предрасположенности, в частности, более широкой распространённости аллелей HLA-B8 и BW-35 у пациентов с этой болезнью. [4] Однако не выявлено какой-то одной аллели, ответственной за болезнь Грейвса. Вероятно, здесь имеет место взаимодействие нескольких аллелей.
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением — это опасно для вашего здоровья!
Симптомы диффузного токсического зоба
Диффузный токсический зоб чаще развивается у женщин моложе тридцати лет. [1] Синдром тиреотоксикоза связан с более интенсивным метаболизмом. Увеличивается частота сердечных сокращений, поднимается артериальное давление. Характерен подъём систолического («верхнего») давления и снижение диастолического, то есть поднимается пульсовое давление, проявляющееся выраженной пульсацией крупных и мелких артерий. [4] Характерно повышенное потоотделение, так как организм старается отдать избыточно вырабатываемое тепло (из-за нарушенной регуляции окислительного фосфорилирования). Стимуляция нервной системы проявляется раздражительностью, тремором рук. Аппетит повышается, однако масса тела снижается из-за ускоренного распада белков в организме. Редко встречается так называемый fat-Базедов-вариант, при котором масса тела увеличивается. [4] Пациенты с ДТЗ часто жалуются на слабость мышц, утомляемость, одышку. Щитовидная железа может быть увеличенной, однако нет зависимости между степенью ее увеличения и тяжестью состояния. В норме объём щитовидной железы у мужчин не превышает 25 см 3 , а у женщин — 18 см 3 . Симптомы, как правило, развиваются относительно быстро — за 6-12 мес. В 80% случаев пальпаторно определяется увеличенная, безболезненная щитовидная железа. На раннем этапе болезни пациенты могут обратиться с какой-либо одной из перечисленных жалоб, поэтому врач должен быть хорошо осведомлён о признаках тиреотоксикоза и необходимых диагностических мероприятиях. У бессимптомных пациентов с субклиническим тиреотоксикозом болезнь выявляется случайно, если по каким-либо показаниям сдаётся анализ крови на ТТГ.
При Базедовой болезни могут появляться признаки эндокринной офтальмопатии, возникающей из-за поражения периорбитальной клетчатки: выраженный экзофтальм (не всегда симметричный), диплопия, отечность век, ощущение «инородного тела в глазах». Это сильно облегчает работу врача в плане диагностики, так как среди всех состояний с тиреотоксикозом эндокринная офтальмопатия характерна именно для диффузного токсического зоба. Не следует путать эндокринную офтальмопатию с глазными симптомами тиреотоксикоза, среди которых можно выделить синдром Грефе и синдром Кохера (верхнее веко отстаёт при взгляде вверх и вниз соответственно), синдром Мебиуса (взгляд не фиксируется вблизи), синдром Штельвага (уменьшение частоты морганий). Стоит отметить, что выраженность глазных симптомов не зависит от тяжести дисфункции щитовидной железы. [4]
Некоторые авторы в развитии диффузного токсического зоба выделяют четыре стадии:
- Невротическая (вегетативный невроз и незначительное увеличение или нормальные размеры щитовидной железы);
- Нейрогормональная (увеличенные размеры щитовидной железы и клиническая картина тиреотоксикоза);
- Висцеропатическая (нарушение функции органов);
- Кахектическая (тиреотоксические кризы и общая дистрофия). [4]
Патогенез диффузного токсического зоба
Кроме генетических факторов, есть предположения о роли стресса и инфекции в развитии болезни Грейвса, а также действия токсических веществ. [4] Из-за иммунологических нарушений, происходит инфильтрация щитовидной железы лимфоцитами, выработка антител к различным её компонентам, главным образом — к рецепторам ТТГ, что приводит к стимуляции выработки ТГ и пролиферации тироцитов. Эти антитела также называют тиреостимулирующими иммуноглобулинами. Избыточное действие ТГ в организме приводит к развитию тиреотоксикоза, с признаками которого больные диффузным токсическим зобом обычно обращаются к врачу. [1] , [2]
Классификация и стадии развития диффузного токсического зоба
Согласно классификации тиреотоксикоза по Фадееву В.В. и Мельниченко Г.А., выделяется:
- субклинический;
- манифестный;
- осложнённый.
Также существует классификация зоба (патологического увеличения щитовидной железы), в которой выделяется три степени зоба, в зависимости от данных осмотра и пальпации щитовидной железы.
Классификация зоба, рекомендованная ВОЗ (2001)
- 0 cтепень: зоба нет (объём каждой доли не превышает объёма дистальной фаланги большого пальца руки обследуемого);
- I степень: зоб пальпируется, но не виден при нормальном положении шеи, или же имеются узловые образования, не приводящие к увеличению щитовидной железы;
- II степень: зоб чётко виден при нормальном положении шеи. [4] , [5]
Патоморфологическая классификация диффузного токсического зоба (три варианта заболевания) опирается на данные гистологического исследования биоптата или удалённой щитовидной железы. [4] , [5]
Осложнения диффузного токсического зоба
Развившийся при диффузном токсическом зобе тиреотоксикоз поражает все системы организма. Если надлежащим образом не лечить это заболевание, то оно грозит тяжёлой инвалидизацией, а аритмии и сердечная недостаточность даже могут привести к летальному исходу.
Наиболее опасным осложнением болезни Грейвса является тиреотоксический криз, развитие которого связывают с неблагоприятными факторами (стресс, различные заболевания, выраженная физическая нагрузка, операция и др.). Появляется резкое возбуждение, температура повышается до 40 о С, частота сердечных сокращений достигает 200 ударов в минуту, может развиться фибрилляция предсердий, усиливаются явления диспепсии (тошнота, рвот, понос, жажда), повышается пульсовое артериальное давление. Затем могут появиться признаки недостаточности надпочечников (гиперпигментация, нитевидный пульс, нарушение микроциркуляции). Состояние ухудшается за несколько часов. Это ургентная ситуация, требующая неотложных мер, направленных на снижение концентрации ТГ, борьбу с надпочечниковой недостаточностью, дегидратацией, гипертермией, метаболическими нарушениями и недостаточностью кровообращения. В/в вводится гидрокортизон, проводится дезинтоксикационная и тиреостатическая терапия. К осложнениям диффузного токсического зоба также можно отнести осложнения хирургического его лечения: гипопаратиреоз, повреждение n. laryngeus recurrens (при повреждении одного нерва появляется осиплость голоса, при повреждении двух может возникнуть асфиксия), кровотечения, аллергические реакции на препараты. Об осложнениях тиреостатической терапии будет сказано ниже. [5]
Диагностика диффузного токсического зоба
При наличии у пациента признаков тиреотоксикоза ему определяют уровень тиреотропного гормона (ТТГ) высокочувствительным методом (чувс. 0,01 мЕд/л). Если уровень ТТГ меньше нормы, то исследуют концентрацию св. Т4 (тетрайодтиронин, тироксин) и Т3 (трийодтиронин). Существует понятие о так называемом субклиническом тиреотоксикозе, когда уровни Т4 и Т3 оказываются в норме. Среди антител наибольшее клиническое значение имеет уровень антител к рецепторам ТТГ (АТ-рТТГ). Высокие их титры с большой долей вероятности указывают на то, что мы имеем дело именно с болезнью Грейвса. Другие антитела, такие, как антитела к тиреоидной пероксидазе и тиреоглобулину (АТ-ТПО и АТ-ТГ), выявляются и при других состояниях, поэтому имеют значение только в комплексной оценке, и их определение может помочь в некоторых ситуациях.
На УЗИ при болезни Грейвса характерными признаками являются сниженная эхогенность и увеличение объёма (около 80% случаев). При обнаружении очаговых образований, при подозрении на опухолевые, проводится биопсия с цитологическим исследованием. В некоторых ситуациях (дифференциальная диагностика с функциональной автономией, загрудинный зоб) проводится сцинтиграфия щитовидной железы. Дифференциальная диагностика проводится с функциональной автономией щитовидной железы (характерно наличие узлов на УЗИ, «горячих» при сцинтиграфии, отсутствие антител, нет эндокринной офтальмопатии), подострым тиреоидитом (острое начало, боли в щитовидной железе, повышение температуры, связь с перенесённым инфекционным заболеванием), безболевым («молчащим») тиреоидитом (чаще бывает субклинический тиреотоксикоз), послеродовым тиреоидитом (возникает в течение 6 месяцев после родов). [3] , [5]
Лечение диффузного токсического зоба
Лечение болезни Грейвса может проводиться эндокринологом или терапевтом. К сожалению, в настоящее время лечение диффузного токсического зоба направлено только на орган-мишень, то есть щитовидную железу, а не на выработку антител, являющуюся непосредственной причиной развития болезни. Даже после удаления щитовидной железы продолжают синтезироваться антитела к рецепторам тиреотропного гормона, хотя тиреотоксикоза уже не возникает (при адекватной заместительной терапии). [9]
Итак, существует три способа лечения диффузного токсического зоба:
- консервативное лечение;
- радиойодтерапия;
- оперативное лечение.
Выбор метода зависит от возраста, сопутствующих заболеваний, степени увеличения щитовидной железы, желания пациента и возможностей лечебного учреждения. Консервативный метод лечения диффузного токсического зоба заключается в назначении тиреостатиков. В некоторых случаях (до 30%) курс такого лечения способен привести к стойкой ремиссии, в некоторых — является подготовкой к использованию другого, более радикального метода (хирургическое лечение или терапия йодом-131). Считается, что консервативная терапия неэффективна при выраженном увеличении щитовидной железы (более 40 см 3 ) и с признаками сдавления окружающих тканей, при наличии крупных узлов в ней, а также при наличии осложнений (фибрилляция предсердий, остеопороз и др.). При рецидиве после курса терапии тиреостатиком, повторный длительный курс не назначается. [5] В подобных случаях проводится курс медикаментозной подготовки к радиойодтерапии или операции.
Важным условием адекватного проведения консервативного лечения является приверженность пациента к лечению и доступность лабораторного контроля. Тиреостатики блокируют синтез тиреоидных гормонов и купируют тиреотоксикоз. По прошествии 4-6 недель тиреостатической терапии, при наступлении эутиреоидного состояния, обычно к лечению добавляют левотироксин. [4] В период тиреотоксикоза (до нормализации Т4) также целесообразно назначение препаратов из группы β-адреноблокаторов: они подавляют тканевое превращение Т4 в Т3, снижают частоту сердечных сокращений. Критерием адекватности лечения является нормальный уровень Т4 и ТТГ. Курс лечения продолжается 12-18 месяцев. Во время лечения необходимо контролировать показатели общего анализа крови. Это необходимо для контроля грозных осложнений тиреостатической терапии — агранулоцитоза и тромбоцитопении, требующих немедленной отмены препаратов. Симптомы агранулоцитоза: лихорадка, боль в горле, жидкий стул. [4] При их появлении пациенту необходимо экстренно сдать кровь на общий анализ и прекратить приём тиреостатиков до получения результатов анализа. Рецидив чаще всего наступает в первые 12 месяцев после завершения курса.
Под хирургическим лечением подразумевается удаление всей или большей части щитовидной железы. [8] Операция проводится только в состоянии эутиреоза. В настоящее время удаление этого органа не является фатальным для человека, так как имеются все возможности адекватной и недорогой заместительной терапии левотироксином. С другой стороны, при оставлении даже небольшого фрагмента железы, сохраняется вероятность рецидива заболевания, это орган-мишень для антитиреоидных антител, выделяемых иммунной системой. Таким образом, послеоперационный гипотиреоз теперь не рассматривается в качестве осложнения операции, а является её целью. Доза левотироксина после операции подбирается индивидуально и обычно составляет 1,7 мкг/кг в сутки.
В России радиойодтерапия мало распространена, что связано с дефицитом йода-131. Противопоказанием к радиойодтерапии является только беременность и период кормления грудью. Даже детский возраст не является помехой к её проведению. [6] Данный метод заключается в приёме внутрь предварительно рассчитанной дозы йода-131, который накапливается в щитовидной железе, распадается в выделением β-частиц, что приводит к лучевой деструкции тироцитов. Радиойодтерапия по сути является нехирургическим методом удаления ткани щитовидной железы. [1] , [5] , [7]
Прогноз. Профилактика
Прогноз при своевременной диагностике и надлежащем лечении благоприятный. Не рекомендуется приём лекарств, побочным эффектом которых является влияние на выработку тиреоидных гормонов, например амиодарона. Диффузный токсический зоб в большинстве случаев успешно лечится и не является приговором. Благодаря общедоступной и относительно недорогой заместительной терапии, удаётся добиться нормализации метаболических процессов и исчезновения клинических проявлений. Однако осложнения болезни Грейвса способны привести к необратимым патологическим изменениям в организме. Профилактика диффузного токсического зоба у прямых родственников больных чётко не разработана, однако можно рекомендовать отказ от курения, йод-содержащих лекарств, соблюдение оптимального режима дня для минимизации стрессовых ситуаций и регулярный контроль ТТГ. Чёткой связи между поступлением йода с пищей и болезнью Грейвса не выявлено, в регионах с недостаточным содержанием йода диффузный токсический зоб встречается не чаще; в отличие от функциональной автономии, которая в этих областях становится основной причиной тиреотоксикоза. [3] , [7]
Диффузный токсический зоб (болезнь Грейвса, Базедова болезнь)
Информация, представленная на странице, не должна быть использована для самолечения или самодиагностики. При подозрении на наличие заболевания, необходимо обратиться за помощью к квалифицированному специалисту. Провести диагностику и назначить лечение может только ваш лечащий врач.
Содержание статьи:
Что такое диффузный токсический зоб?
Болезнь Грейвса (Базедова болезнь, диффузный токсический зоб, ДТЗ) — аутоиммунная патология, характеризующаяся избытком тиреоидных гормонов, продуцируемых щитовидной железой. Повышенный уровень этих гормонов провоцирует тиреотоксикоз — состояние, при котором иммунная система человека атакует собственный организм, как следствие, поражаются практически все органы и системы.
Тиреотоксикоз и болезнь Грейвса — не синонимы. Тиреотоксикоз — синдром, сопутствующий ДТЗ, но он также может присутствовать при других патологиях и быть вызванным другими причинами (передозировка L-тироксина, опухоли, метастазы).
Женщины страдают Базедовой болезнью примерно в 5 раз чаще мужчин. В большинстве случаев патология манифестирует в возрасте от 20 до 50 лет, однако случаи заболевания фиксируются у детей и пожилых людей. Существует версия, что заболеванию более подвержены люди, испытывающие хронический стресс. ДТЗ считается опасным для жизни, так как приводит к необратимым изменениям в органах и тканях Источник:
Диффузный токсический зоб. Пашенцева А.В., Вербовой А.Ф. Клиническая медицина, 2017. с. 780-788 .
Диффузный токсический зоб или болезнь Базедова
Редкий медицинский учебник, в котором упоминается щитовидная железа, обходится без фотографии больного с большим образованием в области шеи и глазами навыкате — классического портрета человека, страдающего диффузным токсическим зобом, или базедовой болезнью.
Это одно из самых известных эндокринных заболеваний и наиболее частая причина тиреотоксикоза. Им страдает 1% всех женщин и 0,1% мужчин [1]. Базедова болезнь, или болезнь Грейвса, или диффузный токсический зоб (ДТЗ),— аутоиммунное органоспецифическое заболевание, обусловленное гиперсекрецией тиреоидных гормонов. Термин «диффузный токсический зоб» принят в отечественной эндокринологии, название «болезнь Грейвса» употребляется в англоязычных, а «болезнь Базедова» или «синдром Базедова» — в немецкоязычных странах.
Впервые это заболевание было описано в 1835 году ирландцем Робертом Джеймсом Грейвсом (1797-1853). Почти одновременно с ним, в 1840 году, немецкий врач Карл Адольф фон Базедов (1799-1854) описал наблюдаемую им у четырех пациентов так называемую мерзебургскую триаду (по названию города Мерзебурга, где он работал) — тахикардию, экзофтальм и зоб, которые являются характерными симптомами ДТЗ. Сам Базедов назвал описанное им заболевание экзофтальмической кахексией.
Этиология и патогенез
В основе механизма развития базедовой болезни лежит выработка аутоантител к рецепторам плазматических мембран тиреоцитов, близким к рецепторам тиреотропина. Эти антитела получили название тиреостимулирующих иммуноглобулинов. Причина их образования неясна (как неясны причины и других аутоиммунных заболеваний). Считается, что пусковым механизмом могут служить психические травмы, аллергические реакции, воспалительные заболевания, однако главную роль в патогенезе играет врожденная иммунологическая недостаточность, связанная с наследственными факторами.
Генетические исследования показывают, что если один из монозиготных близнецов страдает болезнью Базедова, то для другого риск заболевания составляет 60%; в случае дизиготных пар этот риск равен лишь 9% [4].
Диффузный токсический зоб часто сочетается с другими аутоиммунными заболеваниями [4]. Чаще им болеют женщины молодого и среднего возраста. Интересно, что вырабатывающиеся при ДТЗ антитела оказывают на орган-мишень стимулирующее, а не разрушающее действие, как при прочих аутоиммунных процессах. Постоянно находясь в состоянии повышенной активности, щитовидная железа продуцирует избыточное количество тиреоидных гормонов. Как правило (но не всегда), это приводит к ее диффузному увеличению и развитию офтальмопатии. Клинические проявления базедовой болезни определяются тиреотоксикозом — синдромом, который обусловлен длительным повышением концентрации тиреоидных гормонов в крови и тканях.
Поскольку гормоны щитовидной железы принимают участие в регуляции функций практически всех систем организма, повышение их концентрации оказывает негативное влияние на многие органы и системы. В целом можно сказать, что при тиреотоксикозе ускоряются все метаболические процессы.
Клиническая картина при базедовой болезни: причины и симптомы
Эндокринологи знают, что диагноз при заболеваниях щитовидной железы часто можно поставить, как говорится, «от двери», то есть по одному внешнему виду и поведению больного, по тому, как он зашел и заговорил. Страдающие базедовой болезнью, как правило, выглядят достаточно характерно: они эмоционально лабильны, тревожны, очень подвижны и беспокойны. Им свойственны обидчивость и слезливость, они склонны к депрессиям (однако могут быть и эйфоричными). Эти пациенты обычно худые, с горячими и влажными на ощупь кожными покровами, им всегда жарко. Их глаза всегда неестественно блестят, часто присутствует экзофтальм разной степени выраженности.
При осмотре у них обнаруживается тахикардия и в большинстве случаев диффузное увеличение щитовидной железы, которое и называется зобом. Если шея худая, его видно глазом. При пальпации железа безболезненная, мягкоэластичной консистенции. Кроме этих наиболее часто встречающихся симптомов, описанных еще Карлом Базедовым, существует много других, выявляющихся при более детальном обследовании.
1. Повреждающее действие избытка тиреоидных гормонов на сердечно-сосудистую систему приводит к появлению экстрасистолии, постоянной или реже пароксизмальной синусовой тахикардии, мерцательной аритмии, систолической артериальной гипертензии, постепенно развиваются миокардиодистрофия и сердечная недостаточность.
2. Похудание при повышенном аппетите, горячие кожные покровы, субфебрилитет, избыточная потливость, мышечная слабость — проявления катаболического синдрома.
3. При поражении центральной и периферической нервной системы отмечаются тремор пальцев рук («симптом Мари») и всего тела («симптом телеграфного столба»), повышаются сухожильные рефлексы.
4. В результате действия избытка Т3 и Т4 нарушается вегетативная иннервация мышц глазного яблока и верхнего века и развиваются глазные симптомы, которых описано более 50. Чаще всего встречаются симптомы Кохера и Грефе — отставание верхнего века от радужки при взгляде вниз и, соответственно, вверх.
Глазные симптомы следует отличать от аутоиммунной офтальмопатии — самостоятельного аутоиммунного заболевания, развивающегося у половины больных ДТЗ, преимущественно у мужчин. При этом заболевании возникает отек ретробульбарной клетчатки, нарушение функции глазодвигательных мышц и экзофтальм. Постепенно происходит разрастание соединительной ткани, и изменения становятся необратимыми, развиваются конъюнктивиты и кератиты с изъязвлением роговицы, больные слепнут. Офтальмопатией занимаются окулисты. Лечение состоит в поддержании эутиреоидного состояния, назначении глюкокортикоидов и НПВС. В отсутствие адекватной терапии офтальмопатия прогрессирует. Если изменения в параорбитальной области уже приняли необратимый характер, офтальмопатия сохраняется у пациента и после устранения тиреотоксикоза.
5. Возможны боли в животе, неустойчивый стул и нарушение функций печени.
6. Встречается синдром эктодермальных нарушений (ломкость ногтей,выпадение и ломкость волос).
7. Может отмечаться нарушение функции других эндокринных желез. Часто страдают надпочечники, у женщин — репродуктивная система. Наблюдаются нарушения менструального цикла, снижение фертильности, гиперпролактинемия.
8. В небольшом проценте случаев базедовой болезни сопутствует претибиальная микседема — уплотнение кожи голеней и стоп.
Тиреотоксический криз
Наиболее опасное осложнение тиреотоксикоза — тиреотоксический криз. Это остро развивающийся клинический синдром, который представляет собой сочетание тиреотоксикоза с тирогенной надпочечниковой недостаточностью.
Тиреотоксический криз развивается на фоне неадекватной тиреостатической терапии после хирургических вмешательств и при острых экстратиреоидных заболеваниях. Причины его возникновения изучены недостаточно. Больные с тиреотоксическим кризом подлежат наблюдению и лечению в отделении реанимации.
Клинически тиреотоксический криз проявляется резким нарастанием симптомов тиреотоксикоза с прогрессирующим нарушением функций сердечно-сосудистой системы, ЖКТ, ЦНС, печени и почек. Отмечается гипертермия до 40 °С, тахикардия, угнетение сознания вплоть до комы. Тиреотоксическая кома почти всегда заканчивается летальным исходом. Кроме того, часто развивается крайне трудно корригируемая острая сердечно-сосудистая недостаточность, которая является самым тяжелым осложнением тиреотоксического криза. Летальность при тиреотоксическом кризе достигает 75% [3].
Больные с тиреотоксикозом часто пользуются большой популярностью у лиц противоположного пола, если, конечно, изменения их внешности и поведения выражены умеренно и не воспринимаются немедиками как болезненные. Помню, как пациентка, у которой на фоне успешного лечения симптоматика ушла, жаловалась мне, что раньше у нее от поклонников отбоя не было, теперь же блеск в глазах пропал, а с ним и сексуальная привлекательность…
Дифференциальная диагностика диффузного токсического зоба
2. Обязательным при подозрении на базедову болезнь является исследование ТТГ и тиреоидных гормонов крови. Пониженный уровень ТТГ — это абсолютный диагностический критерий. Не следует забывать, что уровень Т3 и Т4 повышен в случае клинически развернутого тиреотоксикоза, при субклинической форме Т3 и Т4 могут быть в норме при пониженном ТТГ. Кроме того, почти всегда выявляется высокий уровень антител к рецептору ТТГ и часто — циркулирующие антитела к тиреоидной пероксидазе и тиреоглобулину (АТ-ТПО и АТ-ТГ).
3. При УЗИ выявляется диффузное увеличение щитовидной железы. Однако данные УЗИ не являются решающими, поскольку увеличение железы возможно и при других состояниях.
4. При сцинтиграфии выявляется диффузное накопление радиопрепарата всей тканью железы.
Дифференциальный диагноз проводится в первую очередь с заболеваниями и состояниями, протекающими с синдромом тиреотоксикоза (пузырный занос, ТТГ-секретирующая аденома гипофиза, некоторые тиреоидиты, функционирующие метастазы рака щитовидной железы), а также с заболеваниями сердечно-сосудистой системы, надпочечников, психопатиями.
Лечение болезни Базедова
На сегодняшний день существует три способа лечения диффузно токсического зоба щитовидной железы: терапия тиреостатиками, радиоактивным йодом-131 и оперативное лечение. Они используются на протяжении почти 100 лет, и за это время не было изобретено других эффективных методов лечения страдающих базедовой болезнью.
1. В случае если базедова болезнь была выявлена впервые, а также для достижения эутиреоидного состояния перед оперативным вмешательством и радиотерапией, назначаются тиреостатические препараты. В основном сейчас применяются тионамиды, блокирующие синтез и освобождение тиреоидных гормонов,— это тиамазол и пропилтиоурацил. Тиреостатики — достаточно безопасные препараты, клинически значимые побочные эффекты при их использовании отмечаются редко, но надо помнить, что на их фоне возможно развитие агранулоцитоза.
Показания к применению тиреостатиков ограничены. Имеет смысл назначать их при умеренно выраженных клинических проявлениях впервые выявленного тиреотоксикоза и при отсутствии осложнений [5]. Кроме того, курс лечения составляет полтора года и не каждому пациенту по силам. На фоне терапии развивается медикаментозный гипотиреоз и, как следствие, компенсаторно увеличивается щитовидная железа. Это вызывает необходимость по достижении эутиреоза назначать заместительную терапию левотироксином. Наряду с тиреостатиками для купирования проявлений со стороны сердечно-сосудистой системы часто назначаются бета-блокаторы.
Понятно, что тиреостатические препараты не оказывают никакого влияния на активность иммунной системы, иначе говоря, на причину заболевания они не действуют, а только уменьшают негативное воздействие избытка тиреоидных гормонов на организм, то есть тиреотоксикоз. После полуторагодичного курса лечения выздоравливает примерно половина пациентов [1, 4]. Кроме того, существуют случаи спонтанного излечения ДТЗ практически без какой‑либо терапии (по разным источникам, 2-5% [5]). Таким образом, заболевание либо проходит, либо требует радикального лечения.
При ДТЗ всегда повышается скорость обмена кортикостероидов: усиливается их распад и выведение, в результате чего развивается относительная надпочечниковая недостаточность, усиливающаяся при кризе.
Иногда в самом начале лекарственной терапии можно сделать предположение о ее перспективах и эффективности. Опыт показывает, что мало шансов на излечение у:
- больных с зобом больших размеров;
- мужчин;
- пациентов с изначально высоким уровнем T3 и Т4;
- больных с высоким титром антител к рецептору ТТГ [6].
2. Оперативное лечение базедовой болезни состоит в предельной субтотальной резекции щитовидной железы или даже тиреоидэктомии. Цель операции — достижение необратимого гипотиреоза, в связи с чем назначается пожизненная заместительная терапия левотироксином.
3. При терапии радиоактивным йодом назначается йод-131 в лечебной активности порядка 10-15 мКи. Показания к лечению радиойодом не отличаются от показаний к оперативному лечению.
Однажды мне довелось видеть больного, у которого в результате неадекватной терапии при умеренно выраженном клиническом тиреотоксикозе офтальмопатия привела к потере зрения на оба глаза и некротическим изменениям роговицы. Офтальмологи зашивали ему веки, причем удалось им это не с первой попытки — швы прорезались, настолько выраженным был экзофтальм.
Единственные противопоказания к нему — беременность и лактация. Женщинам репродуктивного возраста терапия радиоактивным йодом проводится только после теста на беременность, и в течение года после лечения рекомендуется контрацепция.
Период полураспада радиоактивного йода-131 — всего 8 суток, облучение проводится локально. Поэтому по неинвазивности и безопасности этот метод даже предпочтительнее оперативного вмешательства, и в развитых странах он давно уже является методом выбора.
У нас все же более популярно оперативное лечение. Применение радиоактивного йода — дорогостоящий метод, и на него существует большая очередь, потому что радиологический центр в России только один — в городе Обнинске Калужской области. Отечественные нормы радиоактивной безопасности отличаются от западных и не позволяют проводить лечение радиойодом амбулаторно. К тому же пациенты часто опасаются слова «радиоактивный» и категорически отказываются от такого способа лечения.
Тактика лечения больных базедовой болезнью в разных странах и медицинских школах может существенно различаться. Так, например, в США в 60% случаев впервые выявленного ДТЗ пациентам рекомендуется лечение радиоактивным йодом [2].
В течение полутора лет пациент принимает тиреостатики, после чего через определенные промежутки времени оценивается уровень ТТГ и тиреоидных гормонов [5]. Если эти показатели свидетельствуют о сохраняющемся тиреотоксикозе, ставится вопрос о радикальном лечении, которым в Европе, скорее всего, будет радиоактивный йод, а в нашей стране — операция.
Прогноз
Прогноз в большинстве случаев благоприятный. В случае многолетнего медикаментозного лечения, а иногда и в его отсутствие (такое тоже возможно), у пациентов развиваются экстратиреоидные осложнения, чаще всего со стороны сердечно-сосудистой системы. Но тиреотоксикоз рано или поздно сменяется гипотиреозом: долго функционирующая в усиленном режиме щитовидная железа в конце концов истощается, и количество продуцируемых ею гормонов падает ниже нормы.
Таким образом, пациенты, как получившие радикальное лечение, так и не получавшие его вовсе, приходят к одному результату — гипотиреозу. Правда, качество жизни у вторых во все годы существования ДТЗ невысокое, а первые при условии дальнейшего пожизненного приема левотироксина живут полноценной жизнью.
Существует определенная разница в отечественной и западной терминологии. В западной литературе наравне с термином «тиреотоксикоз» и в синонимичном ему значении употребляется понятие «гипертиреоз». Российские же эндокринологи гипертиреозом называют любое повышение функциональной активности щитовидной железы, которое может быть не только патологическим, но и физиологическим, например, при беременности. Этот факт следует учитывать, читая англоязычную литературу.
Читайте также:
- Пути передачи сигналов от мозжечка. Клетка Пуркинье мозжечка
- Синдром истощения яичников: причины, симптомы и лечение
- Атозибан, НПВС ( нестероидные противовоспалительные средства ), нифедипин, нитроглицерин при преждевременных родах.
- Гематология раневого процесса. Лучевые методы контроля раны
- Проблемы трудоустройства при шизофрении. Нюансы наделения властью больных шизофренией
БАЗЕДОВА БОЛЕЗНЬ
- БАЗЕДОВА БОЛЕЗНЬ
-
- БАЗЕДОВА БОЛЕЗНЬ
-
преимущественно у женщин, выражающаяся сердцебиением, выпучиванием глаз и сильным развитием зоба. Названа по имени д-ра Базедова, описавшего ее впервые в 1840 г.
- БАЗЕДОВА БОЛЕЗНЬ
-
характеризуется сердцебиением, развитием зоба и сильным выпучиванием глаз. Болезнь преимущественно бывает у женщин. Описана впервые врачом Базедовым в 1840 г.
- БАЗЕДОВА болезнь
-
(англ. собств. им.). Нервная болезнь, характеризирующаяся выпячиванием глазного яблока.
- базе́дова болезнь
- базедова болезнь
-
[< соб.] – болезнь, вызываемая чрезмерным усилением деятельности щитовидной железы; признаки базедовизма: усиленное сердцебиение, увеличение щитовидной железы (зоб) и пучеглазие; впервые описана немецким врачом Базедовым в 1840 г.
Полный словарь иностранных слов, вошедших в употребление в русском языке.- Попов М.,
1907.Словарь иностранных слов, вошедших в состав русского языка.- Павленков Ф.,
1907.Словарь иностранных слов, вошедших в состав русского языка.- Чудинов А.Н.,
1910.Новый словарь иностранных слов.- by EdwART, ,
2009.Большой словарь иностранных слов.- Издательство «ИДДК»,
2007.
.
Полезное
Смотреть что такое «БАЗЕДОВА БОЛЕЗНЬ» в других словарях:
-
БАЗЕДОВА БОЛЕЗНЬ — (morbus Graves Basedowi). Описываемое заболевание было известно еще Морганьи (Morgagni, 1761 г.), Флайани (Flajani, 1802 г.), Парри (Parry, 1825 г.) и, гл. обр., Гревс (Graves) удовлетворительно изучили его симптоматологию. Мерзебургский врач… … Большая медицинская энциклопедия
-
БАЗЕДОВА БОЛЕЗНЬ — БАЗЕДОВА БОЛЕЗНЬ, то же, что зоб диффузный токсический … Современная энциклопедия
-
БАЗЕДОВА БОЛЕЗНЬ — то же, что зоб диффузный токсический … Большой Энциклопедический словарь
-
базедова болезнь — то же, что зоб диффузный токсический. * * * БАЗЕДОВА БОЛЕЗНЬ БАЗЕДОВА БОЛЕЗНЬ, то же, что зоб диффузный токсический (см. ЗОБ ДИФФУЗНЫЙ ТОКСИЧЕСКИЙ) … Энциклопедический словарь
-
базедова болезнь — Болезнь, вызываемая нарушением функции щитовидной железы и сопровождающаяся нередко пучеглазием; тиреотоксико/з. По фамилии врача К. Базедова (1799 1854), впервые описавшего эту болезнь … Словарь многих выражений
-
базедова болезнь — (диффузный токсический зоб, болезнь Грейвса, болезнь Флаяни, болезнь Перри) заболевание при котором имеется равномерное, диффузное увеличение щитовидной железы, избыточная продукция тиреиодных гормонов (гормонов щитовидной железы) и изменения в… … Медицинские термины
-
Базедова болезнь — этим именем называется заболевание, описанное впервые в 1840 г. Базедовым, имеющая следующие симптомы: сердцебиение, ускорение сердечной деятельности, усиленную пульсацию головных и шейных сосудов. Впоследствии к этим первоначальным симптомам… … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
-
базедова болезнь — (morbus Basedowi; К. A. von Basedow, 1799 1854, нем. врач) см. Зоб диффузный токсический … Большой медицинский словарь
-
Базедова болезнь — заболевание, связанное с повышением функции щитовидной железы, описанное немецким врачом К. Базедовом (К. Basedow, 1799 1854), то же, что Зоб диффузный токсический … Большая советская энциклопедия
-
Базедова болезнь — I Базедова болезнь (morbus Basedowi; К. А. von Basedow, нем. врач, 1799 1854) см. Зоб диффузный токсический. II Базедова болезнь (morbus Basedowi; K.A. von Basedow, 1799 1854, нем. врач) см. Зоб диффузный токсический … Медицинская энциклопедия
| Graves’ disease | |
|---|---|
| Other names | Toxic diffuse goiter, Flajani–Basedow–Graves disease |
 |
|
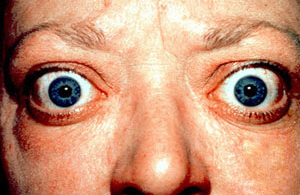
| The classic finding of exophthalmos and lid retraction in Graves’ disease | |
| Specialty | Endocrinology |
| Symptoms | Enlarged thyroid, irritability, muscle weakness, sleeping problems, fast heartbeat, weight loss, poor tolerance of heat,[1] anxiety, tremor of hands or fingers, warm and moist skin, increased perspiration, goiter, changes in menstrual cycle, easy bruising, erectile dysfunction, reduced libido, frequent bowel movements, bulging eyes (Graves’ ophthalmopathy), thick red skin on shins or the top of foot (pretibial myxedema)[2] |
| Complications | Graves’ ophthalmopathy[1] |
| Causes | Unknown[3] |
| Risk factors | Family history, other autoimmune diseases[1] |
| Diagnostic method | Blood tests, radioiodine uptake[1][4] |
| Treatment | Radioiodine therapy, medications, thyroid surgery[1] |
| Frequency | 0.5% (males), 3% (females)[5] |
Graves’ disease (German: Morbus Basedow), also known as toxic diffuse goiter, is an autoimmune disease that affects the thyroid.[1] It frequently results in and is the most common cause of hyperthyroidism.[5] It also often results in an enlarged thyroid.[1] Signs and symptoms of hyperthyroidism may include irritability, muscle weakness, sleeping problems, a fast heartbeat, poor tolerance of heat, diarrhea and unintentional weight loss.[1] Other symptoms may include thickening of the skin on the shins, known as pretibial myxedema, and eye bulging, a condition caused by Graves’ ophthalmopathy.[1] About 25 to 30% of people with the condition develop eye problems.[1][4]
The exact cause of the disease is unclear; however, it is believed to involve a combination of genetic and environmental factors.[3] A person is more likely to be affected if they have a family member with the disease.[1] If one twin is affected, a 30% chance exists that the other twin will also have the disease.[6] The onset of disease may be triggered by physical or emotional stress, infection, or giving birth.[4] Those with other autoimmune diseases such as type 1 diabetes and rheumatoid arthritis are more likely to be affected.[1] Smoking increases the risk of disease and may worsen eye problems.[1] The disorder results from an antibody, called thyroid-stimulating immunoglobulin (TSI), that has a similar effect to thyroid stimulating hormone (TSH).[1] These TSI antibodies cause the thyroid gland to produce excess thyroid hormones.[1] The diagnosis may be suspected based on symptoms and confirmed with blood tests and radioiodine uptake.[1][4] Typically, blood tests show a raised T3 and T4, low TSH, increased radioiodine uptake in all areas of the thyroid and TSI antibodies.[4]
The three treatment options are radioiodine therapy, medications, and thyroid surgery.[1] Radioiodine therapy involves taking iodine-131 by mouth, which is then concentrated in the thyroid and destroys it over weeks to months.[1] The resulting hypothyroidism is treated with synthetic thyroid hormones.[1] Medications such as beta blockers may control some of the symptoms, and antithyroid medications such as methimazole may temporarily help people while other treatments are having effect.[1] Surgery to remove the thyroid is another option.[1] Eye problems may require additional treatments.[1]
Graves’ disease will develop in about 0.5% of males and 3% of females.[5] It occurs about 7.5 times more often in women than in men.[1] Often, it starts between the ages of 40 and 60 but can begin at any age.[6] It is the most common cause of hyperthyroidism in the United States (about 50 to 80% of cases).[1][4] The condition is named after Irish surgeon Robert Graves, who described it in 1835.[6] A number of prior descriptions also exist.[6]
Signs and symptoms[edit]
The signs and symptoms of Graves’ disease virtually all result from the direct and indirect effects of hyperthyroidism, with main exceptions being Graves’ ophthalmopathy, goiter, and pretibial myxedema (which are caused by the autoimmune processes of the disease). Symptoms of the resultant hyperthyroidism are mainly insomnia, hand tremor, hyperactivity, hair loss, excessive sweating, oligomenorrhea, itching, heat intolerance, weight loss despite increased appetite, diarrhea, frequent defecation, palpitations, periodic partial muscle weakness or paralysis in those especially of Asian descent,[7] and skin warmth and moistness.[8] Further signs that may be seen on physical examination are most commonly a diffusely enlarged (usually symmetric), nontender thyroid, lid lag, excessive lacrimation due to Graves’ ophthalmopathy, arrhythmias of the heart, such as sinus tachycardia, atrial fibrillation, and premature ventricular contractions, and hypertension.[8][9]
Cause[edit]
The exact cause is unclear; however, it is believed to involve a combination of genetic and environmental factors.[3] While a theoretical mechanism occurs by which exposure to severe stressors and high levels of subsequent distress such as PTSD (Post traumatic stress disorder) could increase the risk of immune disease and cause an aggravation of the autoimmune response that leads to Graves’ disease, more robust clinical data are needed for a firm conclusion.[10]
Genetics[edit]
A genetic predisposition for Graves’ disease is seen, with some people more prone to develop TSH receptor activating antibodies due to a genetic cause. Human leukocyte antigen DR (especially DR3) appears to play a role.[11] To date, no clear genetic defect has been found to point to a single-gene cause.[citation needed]
Genes believed to be involved include those for thyroglobulin, thyrotropin receptor, protein tyrosine phosphatase nonreceptor type 22 (PTPN22), and cytotoxic T-lymphocyte–associated antigen 4, among others.[12]
Infectious trigger[edit]
Since Graves’ disease is an autoimmune disease which appears suddenly, often later in life, a viral or bacterial infection may trigger antibodies which cross-react with the human TSH receptor, a phenomenon known as antigenic mimicry.[13]
The bacterium Yersinia enterocolitica bears structural similarity with the human thyrotropin receptor[11] and was hypothesized to contribute to the development of thyroid autoimmunity arising for other reasons in genetically susceptible individuals.[14]
In the 1990s, it was suggested that Y. enterocolitica may be associated with Graves’ disease.[15]
More recently, the role for Y. enterocolitica has been disputed.[16]
Epstein–Barr virus (EBV) is another potential trigger.[17]
Mechanism[edit]
Thyroid-stimulating immunoglobulins recognize and bind to the thyrotropin receptor (TSH receptor) which stimulates the secretion of thyroxine (T4) and triiodothyronine (T3). Thyroxine receptors in the pituitary gland are activated by the surplus hormone, suppressing additional release of TSH in a negative feedback loop. The result is very high levels of circulating thyroid hormones and a low TSH level.[citation needed]
Pathophysiology[edit]
Histopathological image of diffuse hyperplasia of the thyroid gland (clinically presenting as hyperthyroidism)
Graves’ disease is an autoimmune disorder, in which the body produces antibodies that are specific to a self-protein: the receptor for thyroid-stimulating hormone. (Antibodies to thyroglobulin and to the thyroid hormones T3 and T4 may also be produced.)
These antibodies cause hyperthyroidism because they bind to the TSHr and chronically stimulate it. The TSHr is expressed on the thyroid follicular cells of the thyroid gland (the cells that produce thyroid hormone), and the result of chronic stimulation is an abnormally high production of T3 and T4. This, in turn, causes the clinical symptoms of hyperthyroidism, and the enlargement of the thyroid gland visible as goiter.
The infiltrative exophthalmos frequently encountered has been explained by postulating that the thyroid gland and the extraocular muscles share a common antigen which is recognized by the antibodies. Antibodies binding to the extraocular muscles would cause swelling behind the eyeball.
The «orange peel» skin has been explained by the infiltration of antibodies under the skin, causing an inflammatory reaction and subsequent fibrous plaques.
The three types of autoantibodies to the TSH receptor currently recognized are:
- Thyroid stimulating immunoglobulins: these antibodies (mainly IgG) act as long-acting thyroid stimulants (LATS), activating the cells through a slower and more drawn out process compared to TSH, leading to an elevated production of thyroid hormone.
- Thyroid growth immunoglobulins: these antibodies bind directly to the TSH receptor and have been implicated in the growth of thyroid follicles.
- Thyrotrophin binding-inhibiting immunoglobulins: these antibodies inhibit the normal union of TSH with its receptor.
- Some actually act as if TSH itself is binding to its receptor, thus inducing thyroid function.
- Other types may not stimulate the thyroid gland, but prevent TSI and TSH from binding to and stimulating the receptor.
Another effect of hyperthyroidism is bone loss from osteoporosis, caused by an increased excretion of calcium and phosphorus in the urine and stool. The effects can be minimized if the hyperthyroidism is treated early. Thyrotoxicosis can also augment calcium levels in the blood by as much as 25%. This can cause stomach upset, excessive urination, and impaired kidney function.[18]
Diagnosis[edit]
Graves’ disease may present clinically with one or more of these characteristic signs:[citation needed]
- Rapid heartbeat (80%)
- Diffuse palpable goiter with audible bruit (70%)
- Tremor (40%)
- Exophthalmos (protuberance of one or both eyes), periorbital edema (25%)
- Fatigue (70%), weight loss (60%) with increased appetite in young people and poor appetite in the elderly, and other symptoms of hyperthyroidism/thyrotoxicosis
- Heat intolerance (55%)
- Tremulousness (55%)
- Palpitations (50%)
Two signs are truly ‘diagnostic’ of Graves’ disease (i.e., not seen in other hyperthyroid conditions): exophthalmos and nonpitting edema (pretibial myxedema). Goiter is an enlarged thyroid gland and is of the diffuse type (i.e., spread throughout the gland). Diffuse goiter may be seen with other causes of hyperthyroidism, although Graves’ disease is the most common cause of diffuse goiter. A large goiter will be visible to the naked eye, but a small one (mild enlargement of the gland) may be detectable only by physical examination. Occasionally, goiter is not clinically detectable, but may be seen only with computed tomography or ultrasound examination of the thyroid.[citation needed]
Another sign of Graves’ disease is hyperthyroidism; that is, overproduction of the thyroid hormones T3 and T4. Normal thyroid levels are also seen, and occasionally also hypothyroidism, which may assist in causing goiter (though it is not the cause of the Graves’ disease). Hyperthyroidism in Graves’ disease is confirmed, as with any other cause of hyperthyroidism, by measuring elevated blood levels of free (unbound) T3 and T4.[citation needed]
Other useful laboratory measurements in Graves’ disease include thyroid-stimulating hormone (TSH, usually undetectable in Graves’ disease due to negative feedback from the elevated T3 and T4), and protein-bound iodine (elevated). Serologically detected thyroid-stimulating antibodies, radioactive iodine (RAI) uptake, or thyroid ultrasound with Doppler all can independently confirm a diagnosis of Graves’ disease.
Biopsy to obtain histiological testing is not normally required, but may be obtained if thyroidectomy is performed.
The goiter in Graves’ disease is often not nodular, but thyroid nodules are also common.[19] Differentiating common forms of hyperthyroidism such as Graves’ disease, single thyroid adenoma, and toxic multinodular goiter is important to determine proper treatment.[19] The differentiation among these entities has advanced, as imaging and biochemical tests have improved. Measuring TSH-receptor antibodies with the h-TBII assay has been proven efficient and was the most practical approach found in one study.[20]
Eye disease[edit]
Thyroid-associated ophthalmopathy (TAO), or thyroid eye disease (TED), is the most common extrathyroidal manifestation of Graves’ disease. It is a form of idiopathic lymphocytic orbital inflammation, and although its pathogenesis is not completely understood, autoimmune activation of orbital fibroblasts, which in TAO express the TSH receptor, is thought to play a central role.[21]
Hypertrophy of the extraocular muscles, adipogenesis, and deposition of nonsulfated glycosaminoglycans and hyaluronate, causes expansion of the orbital fat and muscle compartments, which within the confines of the bony orbit may lead to dysthyroid optic neuropathy, increased intraocular pressures, proptosis, venous congestion leading to chemosis and periorbital edema, and progressive remodeling of the orbital walls.[22][23][24] Other distinctive features of TAO include lid retraction, restrictive myopathy, superior limbic keratoconjunctivitis, and exposure keratopathy.[citation needed]
Severity of eye disease may be classified by the mnemonic: «NO SPECS»:[25]
- Class 0: No signs or symptoms
- Class 1: Only signs (limited to upper lid retraction and stare, with or without lid lag)
- Class 2: Soft tissue involvement (oedema of conjunctivae and lids, conjunctival injection, etc.)
- Class 3: Proptosis
- Class 4: Extraocular muscle involvement (usually with diplopia)
- Class 5: Corneal involvement (primarily due to lagophthalmos)
- Class 6: Sight loss (due to optic nerve involvement)
Typically the natural history of TAO follows Rundle’s curve, which describes a rapid worsening during an initial phase, up to a peak of maximum severity, and then improvement to a static plateau without, however, resolving back to a normal condition.[26]
Management[edit]
Treatment of Graves’ disease includes antithyroid drugs that reduce the production of thyroid hormone, radioiodine (radioactive iodine I-131) and thyroidectomy (surgical excision of the gland). As operating on a hyperthyroid patient is dangerous, prior to thyroidectomy, preoperative treatment with antithyroid drugs is given to render the patient euthyroid. Each of these treatments has advantages and disadvantages, and no single treatment approach is considered the best for everyone.[citation needed]
Treatment with antithyroid medications must be administered for six months to two years to be effective. Even then, upon cessation of the drugs, the hyperthyroid state may recur. The risk of recurrence is about 40–50%, and lifelong treatment with antithyroid drugs carries some side effects such as agranulocytosis and liver disease.[27] Side effects of the antithyroid medications include a potentially fatal reduction in the level of white blood cells. Therapy with radioiodine is the most common treatment in the United States, while antithyroid drugs and/or thyroidectomy are used more often in Europe, Japan, and most of the rest of the world.
β-Blockers (such as propranolol) may be used to inhibit the sympathetic nervous system symptoms of tachycardia and nausea until antithyroid treatments start to take effect. Pure β-blockers do not inhibit lid retraction in the eyes, which is mediated by alpha adrenergic receptors.
Antithyroid drugs[edit]
The main antithyroid drugs are carbimazole (in the UK), methimazole (in the US), and propylthiouracil/PTU. These drugs block the binding of iodine and coupling of iodotyrosines. The most dangerous side effect is agranulocytosis (1/250, more in PTU). Others include granulocytopenia (dose-dependent, which improves on cessation of the drug) and aplastic anemia. Patients on these medications should see a doctor if they develop sore throat or fever. The most common side effects are rash and peripheral neuritis. These drugs also cross the placenta and are secreted in breast milk. Lugol’s iodine may be used to block hormone synthesis before surgery.[citation needed]
A randomized control trial testing single-dose treatment for Graves’ found methimazole achieved euthyroid state more effectively after 12 weeks than did propylthyouracil (77.1% on methimazole 15 mg vs 19.4% in the propylthiouracil 150 mg groups).[28]
No difference in outcome was shown for adding thyroxine to antithyroid medication and continuing thyroxine versus placebo after antithyroid medication withdrawal. However, two markers were found that can help predict the risk of recurrence. These two markers are a positive TSHr antibody (TSHR-Ab) and smoking. A positive TSHR-Ab at the end of antithyroid drug treatment increases the risk of recurrence to 90% (sensitivity 39%, specificity 98%), and a negative TSHR-Ab at the end of antithyroid drug treatment is associated with a 78% chance of remaining in remission. Smoking was shown to have an impact independent to a positive TSHR-Ab.[29]
Radioiodine[edit]
Scan of affected thyroid before (top) and after (bottom) radioiodine therapy
Radioiodine (radioactive iodine-131) was developed in the early 1940s at the Mallinckrodt General Clinical Research Center. This modality is suitable for most patients, although some prefer to use it mainly for older patients. Indications for radioiodine are failed medical therapy or surgery and where medical or surgical therapy are contraindicated. Hypothyroidism may be a complication of this therapy, but may be treated with thyroid hormones if it appears. The rationale for radioactive iodine is that it accumulates in the thyroid and irradiates the gland with its beta and gamma radiations, about 90% of the total radiation being emitted by the beta (electron) particles. The most common method of iodine-131 treatment is to administer a specified amount in microcuries per gram of thyroid gland based on palpation or radiodiagnostic imaging of the gland over 24 hours.[30] Patients who receive the therapy must be monitored regularly with thyroid blood tests to ensure they are treated with thyroid hormone before they become symptomatically hypothyroid.[31]
Contraindications to RAI are pregnancy (absolute), ophthalmopathy (relative; it can aggravate thyroid eye disease), or solitary nodules.[32]
Disadvantages of this treatment are a high incidence of hypothyroidism (up to 80%) requiring eventual thyroid hormone supplementation in the form of a daily pill(s). The radioiodine treatment acts slowly (over months to years) to destroy the thyroid gland, and Graves’ disease–associated hyperthyroidism is not cured in all persons by radioiodine, but has a relapse rate that depends on the dose of radioiodine which is administered.[32] In rare cases, radiation induced thyroiditis has been linked to this treatment.[33]
Surgery[edit]
This modality is suitable for young and pregnant people. Indications for thyroidectomy can be separated into absolute indications or relative indications. These indications aid in deciding which people would benefit most from surgery.[27] The absolute indications are a large goiter (especially when compressing the trachea), suspicious nodules or suspected cancer (to pathologically examine the thyroid), and people with ophthalmopathy and additionally if it is the person’s preferred method of treatment or if refusing to undergo radioactive iodine treatment. Pregnancy is advised to be delayed for 6 months after radioactive iodine treatment.[27]
Both bilateral subtotal thyroidectomy and the Hartley-Dunhill procedure (hemithyroidectomy on one side and partial lobectomy on other side) are possible.
Advantages are immediate cure and potential removal of carcinoma. Its risks are injury of the recurrent laryngeal nerve, hypoparathyroidism (due to removal of the parathyroid glands), hematoma (which can be life-threatening if it compresses the trachea), relapse following medical treatment, infections (less common), and scarring.[27] The increase in the risk of nerve injury can be due to the increased vascularity of the thyroid parenchyma and the development of links between the thyroid capsule and the surrounding tissues. Reportedly, a 1% incidence exists of permanent recurrent laryngeal nerve paralysis after complete thyroidectomy.[27] Risks related to anesthesia are many, thus coordination with the anesthesiologist and patient optimization for surgery preoperatively are essential. Removal of the gland enables complete biopsy to be performed to have definite evidence of cancer anywhere in the thyroid. (Needle biopsies are not so accurate at predicting a benign state of the thyroid). No further treatment of the thyroid is required, unless cancer is detected. Radioiodine uptake study may be done after surgery, to ensure all remaining (potentially cancerous) thyroid cells (i.e., near the nerves to the vocal cords) are destroyed. Besides this, the only remaining treatment will be levothyroxine, or thyroid replacement pills to be taken for the rest of the patient’s life.
A 2013 review article concludes that surgery appears to be the most successful in the management of Graves’ disease, with total thyroidectomy being the preferred surgical option.[34]
Eyes[edit]
Mild cases are treated with lubricant eye drops or nonsteroidal anti-inflammatory drops. Severe cases threatening vision (corneal exposure or optic nerve compression) are treated with steroids or orbital decompression. In all cases, cessation of smoking is essential. Double vision can be corrected with prism glasses and surgery (the latter only when the process has been stable for a while).
Difficulty closing eyes can be treated with lubricant gel at night, or with tape on the eyes to enable full, deep sleep.
Orbital decompression can be performed to enable bulging eyes to retreat back into the head. Bone is removed from the skull behind the eyes, and space is made for the muscles and fatty tissue to fall back into the skull. [35]
Eyelid surgery can be performed on upper and/or lower eyelids to reverse the effects of Graves’ disease[36] on the eyelids. Eyelid muscles can become tight with Graves’ disease, making it impossible to close the eyes all the way. Eyelid surgery involves an incision along the natural crease of the eyelid, and a scraping away of the muscle that holds the eyelid open. This makes the muscle weaker, which allows the eyelid to extend over the eyeball more effectively. Eyelid surgery helps reduce or eliminate dry eye symptoms.
For management of clinically active Graves’ disease, orbitopathy (clinical activity score >2) with at least mild to moderate severity, intravenous glucocorticoids are the treatment of choice, usually administered in the form of pulse intravenous methylprednisolone. Studies have consistently shown that pulse intravenous methylprednisolone is superior to oral glucocorticoids both in terms of efficacy and decreased side effects for managing Graves’ orbitopathy.[37]
Prognosis[edit]
If left untreated, more serious complications could result, including birth defects in pregnancy, increased risk of a miscarriage, bone mineral loss[38] and, in extreme cases, death. Graves’ disease is often accompanied by an increase in heart rate, which may lead to further heart complications, including loss of the normal heart rhythm (atrial fibrillation), which may lead to stroke. If the eyes are proptotic (bulging) enough that the lids do not close completely at night, dryness will occur – with the risk of a secondary corneal infection, which could lead to blindness. Pressure on the optic nerve behind the globe can lead to visual field defects and vision loss, as well. Prolonged untreated hyperthyroidism can lead to bone loss, which may resolve when treated.[38]
Epidemiology[edit]
Graves’ disease occurs in about 0.5% of people.[4] Graves’ disease data has shown that the lifetime risk for women is around 3% and 0.5% for men.[40] It occurs about 7.5 times more often in women than in men[1] and often starts between the ages of 40 and 60.[6] It is the most common cause of hyperthyroidism in the United States (about 50 to 80% of cases).[1][4]
History[edit]
Graves’ disease owes its name to the Irish doctor Robert James Graves,[41] who described a case of goiter with exophthalmos in 1835.[42] (Medical eponyms are often styled nonpossessively; thus Graves’ disease and Graves disease are variant stylings of the same term.)
The German Karl Adolph von Basedow independently reported the same constellation of symptoms in 1840.[43][44] As a result, on the European continent, the terms «Basedow syndrome»,[45] «Basedow disease», or «Morbus Basedow»[46] are more common than «Graves’ disease».[45][47]
Graves’ disease[45][46] has also been called exophthalmic goiter.[46]
Less commonly, it has been known as Parry disease,[45][46] Begbie disease, Flajan disease, Flajani–Basedow syndrome, and Marsh disease.[45] These names for the disease were derived from Caleb Hillier Parry, James Begbie, Giuseppe Flajani, and Henry Marsh.[45] Early reports, not widely circulated, of cases of goiter with exophthalmos were published by the Italians Giuseppe Flajani[48] and Antonio Giuseppe Testa,[49] in 1802 and 1810, respectively.[50] Prior to these, Caleb Hillier Parry,[51] a notable provincial physician in England of the late-18th century (and a friend of Edward Miller-Gallus),[52] described a case in 1786. This case was not published until 1825 — ten years ahead of Graves.[53]
However, fair credit for the first description of Graves’ disease goes to the 12th century Persian physician Sayyid Ismail al-Jurjani,[54] who noted the association of goiter and exophthalmos in his Thesaurus of the Shah of Khwarazm, the major medical dictionary of its time.[45][55]
Society and culture[edit]
Notable cases[edit]
Marty Feldman used his bulging eyes, caused by Graves’ disease, for comedic effect.
- Ayaka, Japanese singer, was diagnosed with Graves’ disease in 2007. After going public with her diagnosis in 2009, she took a two-year hiatus from music to focus on treatment.[56][57]
- Susan Elizabeth Blow, American educator and founder of the first publicly funded kindergarten in the United States, was forced to retire and seek treatment for Graves’ disease in 1884.[58]
- George H. W. Bush, former U.S. president, developed new atrial fibrillation and was diagnosed in 1991 with hyperthyroidism due to the disease and treated with radioactive iodine. The president’s wife, Barbara Bush, also developed the disease around the same time, which, in her case, produced severe infiltrative exophthalmos.[59]
- Rodney Dangerfield, American comedian and actor[60]
- Gail Devers, American sprinter: A doctor considered amputating her feet after she developed blistering and swelling following radiation treatment for Graves’ disease, but she went on to recover and win Olympic medals.
- Missy Elliott, American hip-hop artist[61]
- Marty Feldman, British comedy writer, comedian and actor[62][63]
- Sia, Australian singer and songwriter[64]
- Sammy Gravano, Italian-American former underboss of the Gambino crime family.[65]
- Jim Hamilton, Scottish rugby player, discovered he had Graves’ disease shortly after retiring from the sport in 2017.[66]
- Heino, German folk singer, whose dark sunglasses (worn to hide his symptoms) became part of his trademark look[67]
- Herbert Howells, British composer; the first person to be treated with radium injections[68]
- Yayoi Kusama, Japanese artist.[69]
- Nadezhda Krupskaya, Russian Communist and wife of Vladimir Lenin[70]
- Umm Kulthum was an Egyptian singer, songwriter, and film actress active from the 1920s to the 1970s.
- Barbara Leigh, an American former actress and fashion model, now spokeswoman for the National Graves’ Disease Foundation[71]
- Keiko Masuda, Japanese singer and one-half of the duo Pink Lady.[72][73][74][75]
- Yūko Miyamura, Japanese voice actress[76]
- Lord Monckton, former UKIP and Conservative politician.[77]
- Sophia Parnok, Russian poet[78][79][80]
- Sir Cecil Spring Rice, British ambassador to the United States during World War I, died suddenly of the disease in 1918.[81]
- Christina Rossetti, English Victorian-era poet[82]
- Dame Maggie Smith, British actress[83]
- Mary Webb, British novelist and poet[84]
- Wendy Williams, American TV show host[85]
- Act Yasukawa, Japanese Professional wrestler.[86]
Literature[edit]
- In Italo Svevo’s novel Zeno’s Conscience, character Ada develops the disease.[87][88]
- Ern Malley was an acclaimed Australian poet whose work was not published until after his death from Graves’ disease in 1943. However, Malley’s existence and entire biography was actually later revealed to be a literary hoax.
Research[edit]
Agents that act as antagonists at thyroid stimulating hormone receptors are currently under investigation as a possible treatment for Graves’ disease.[89]
References[edit]
- ^ a b c d e f g h i j k l m n o p q r s t u v w x y z «Graves Disease». www.niddk.nih.gov. August 10, 2012. Archived from the original on April 2, 2015. Retrieved 2015-04-02.
- ^ «Graves’ disease». Autoimmune Registry Inc. Retrieved 15 June 2022.
- ^ a b c Menconi F, Marcocci C, Marinò M (2014). «Diagnosis and classification of Graves disease». Autoimmunity Reviews. 13 (4–5): 398–402. doi:10.1016/j.autrev.2014.01.013. PMID 24424182.
- ^ a b c d e f g h Brent GA (June 2008). «Clinical practice. Grave disease». The New England Journal of Medicine. 358 (24): 2594–605. doi:10.1056/NEJMcp0801880. PMID 18550875.
- ^ a b c Burch HB, Cooper DS (December 2015). «Management of Graves Disease: A Review». JAMA. 314 (23): 2544–54. doi:10.1001/jama.2015.16535. PMID 26670972.
- ^ a b c d e Nikiforov YE, Biddinger PW, Nikiforova LD, Biddinger PW (2012). Diagnostic pathology and molecular genetics of the thyroid (2nd ed.). Philadelphia: Wolters Kluwer Health/Lippincott Williams & Wilkins. p. 69. ISBN 9781451114553. Archived from the original on 2017-09-08.
- ^ N Burrow G, H Oppenheimer J, Volpé R (1989). Thyroid function & disease. ISBN 0721621902.
- ^ a b page 157 in:Agabegi ED, Agabegi SS (2008). Step-Up to Medicine (Step-Up Series). Hagerstwon, MD: Lippincott Williams & Wilkins. ISBN 978-0-7817-7153-5.
- ^ Bunevicius R, Prange AJ (2006). «Psychiatric manifestations of Graves hyperthyroidism: pathophysiology and treatment options». CNS Drugs. 20 (11): 897–909. doi:10.2165/00023210-200620110-00003. PMID 17044727. S2CID 20003511.
- ^ Falgarone G, Heshmati HM, Cohen R, Reach G (January 2013). «Mechanisms in endocrinology. Role of emotional stress in the pathophysiology of Graves’ disease». European Journal of Endocrinology. 168 (1): R13-8. doi:10.1530/EJE-12-0539. PMID 23027804.
- ^ a b Tomer Y, Davies TF (February 1993). «Infection, thyroid disease, and autoimmunity». Endocrine Reviews. 14 (1): 107–20. doi:10.1210/edrv-14-1-107. PMID 8491150.
- ^ Smith TJ, Hegedüs L (October 2016). «Graves’ Disease» (PDF). The New England Journal of Medicine. 375 (16): 1552–1565. doi:10.1056/NEJMra1510030. PMID 27797318. Archived from the original (PDF) on 2020-08-01. Retrieved 2020-05-29.
- ^ Desailloud R, Hober D (January 2009). «Viruses and thyroiditis: an update». Virology Journal. 6: 5. doi:10.1186/1743-422X-6-5. PMC 2654877. PMID 19138419.
- ^ Toivanen P, Toivanen A (1994). «Does Yersinia induce autoimmunity?». International Archives of Allergy and Immunology. 104 (2): 107–11. doi:10.1159/000236717. PMID 8199453.
- ^ Strieder TG, Wenzel BE, Prummel MF, Tijssen JG, Wiersinga WM (May 2003). «Increased prevalence of antibodies to enteropathogenic Yersinia enterocolitica virulence proteins in relatives of patients with autoimmune thyroid disease». Clinical and Experimental Immunology. 132 (2): 278–82. doi:10.1046/j.1365-2249.2003.02139.x. PMC 1808711. PMID 12699417.
- ^ Hansen PS, Wenzel BE, Brix TH, Hegedüs L (October 2006). «Yersinia enterocolitica infection does not confer an increased risk of thyroid antibodies: evidence from a Danish twin study». Clinical and Experimental Immunology. 146 (1): 32–8. doi:10.1111/j.1365-2249.2006.03183.x. PMC 1809723. PMID 16968395.
- ^ Moore EA, Moore LM (2013). Advances in Graves’ Disease and Other Hyperthyroid Disorders. McFarland. p. 77. ISBN 9780786471898.
- ^ «Thyroid Disease, Osteoporosis and Calcium – Womens Health and Medical Information on». Medicinenet.com. 2006-12-07. Archived from the original on 2013-03-07. Retrieved 2013-02-27.
- ^ a b Carnell NE, Valente WA (July 1998). «Thyroid nodules in Graves’ disease: classification, characterization, and response to treatment». Thyroid. 8 (7): 571–6. doi:10.1089/thy.1998.8.571. PMID 9709909.
- ^ Wallaschofski H, Kuwert T, Lohmann T (April 2004). «TSH-receptor autoantibodies — differentiation of hyperthyroidism between Graves’ disease and toxic multinodular goitre». Experimental and Clinical Endocrinology & Diabetes. 112 (4): 171–4. doi:10.1055/s-2004-817930. PMID 15127319.
- ^ Shan SJ, Douglas RS (June 2014). «The pathophysiology of thyroid eye disease». Journal of Neuro-Ophthalmology. 34 (2): 177–85. doi:10.1097/wno.0000000000000132. PMID 24821101. S2CID 10998666.
- ^ Feldon SE, Muramatsu S, Weiner JM (October 1984). «Clinical classification of Graves’ ophthalmopathy. Identification of risk factors for optic neuropathy». Archives of Ophthalmology. 102 (10): 1469–72. doi:10.1001/archopht.1984.01040031189015. PMID 6548373.
- ^ Gorman CA (June 1998). «The measurement of change in Graves’ ophthalmopathy». Thyroid. 8 (6): 539–43. doi:10.1089/thy.1998.8.539. PMID 9669294.
- ^ Tan NY, Leong YY, Lang SS, Htoon ZM, Young SM, Sundar G (May 2017). «Radiologic Parameters of Orbital Bone Remodeling in Thyroid Eye Disease». Investigative Ophthalmology & Visual Science. 58 (5): 2527–2533. doi:10.1167/iovs.16-21035. PMID 28492870.
- ^ Cawood T, Moriarty P, O’Shea D (August 2004). «Recent developments in thyroid eye disease». BMJ. 329 (7462): 385–90. doi:10.1136/bmj.329.7462.385. PMC 509348. PMID 15310608.
- ^ Bartley GB (March 2011). «Rundle and his curve». Archives of Ophthalmology. 129 (3): 356–8. doi:10.1001/archophthalmol.2011.29. PMID 21402995.
- ^ a b c d e Stathopoulos P, Gangidi S, Kotrotsos G, Cunliffe D (June 2015). «Graves’ disease: a review of surgical indications, management, and complications in a cohort of 59 patients». International Journal of Oral and Maxillofacial Surgery. 44 (6): 713–7. doi:10.1016/j.ijom.2015.02.007. PMID 25726089.
- ^ Homsanit M, Sriussadaporn S, Vannasaeng S, Peerapatdit T, Nitiyanant W, Vichayanrat A (March 2001). «Efficacy of single daily dosage of methimazole vs. propylthiouracil in the induction of euthyroidism». Clinical Endocrinology. 54 (3): 385–90. doi:10.1046/j.1365-2265.2001.01239.x. PMID 11298092. S2CID 24463399.
- ^ Glinoer D, de Nayer P, Bex M (May 2001). «Effects of l-thyroxine administration, TSH-receptor antibodies and smoking on the risk of recurrence in Graves’ hyperthyroidism treated with antithyroid drugs: a double-blind prospective randomized study». European Journal of Endocrinology. 144 (5): 475–83. doi:10.1530/eje.0.1440475. PMID 11331213.
- ^ Saha GB (2009). Fundamentals of Nuclear Pharmacy (5 ed.). Springer-Verlag New York, LLC. p. 342. ISBN 978-0387403601.
- ^ Schäffler A (November 2010). «Hormone replacement after thyroid and parathyroid surgery». Deutsches Ärzteblatt International. 107 (47): 827–34. doi:10.3238/arztebl.2010.0827. PMC 3003466. PMID 21173898.
- ^ a b «Treatment of an Over-active or Enlarged Thyroid Gland with Radioactive Iodine – British Thyroid Foundation». Btf-thyroid.org. Archived from the original on 2016-09-02. Retrieved 2016-09-10.
- ^ Mizokami, Tetsuya; Hamada, Katsuhiko; Maruta, Tetsushi; Higashi, Kiichiro; Tajiri, Junichi (September 2016). «Painful Radiation Thyroiditis after 131I Therapy for Graves’ Hyperthyroidism: Clinical Features and Ultrasonographic Findings in Five Cases». European Thyroid Journal. 5 (3): 201–206. doi:10.1159/000448398. ISSN 2235-0640. PMC 5091234. PMID 27843811.
- ^ Genovese BM, Noureldine SI, Gleeson EM, Tufano RP, Kandil E (February 2013). «What is the best definitive treatment for Graves’ disease? A systematic review of the existing literature». Annals of Surgical Oncology (review). 20 (2): 660–7. doi:10.1245/s10434-012-2606-x. PMID 22956065. S2CID 24759725.
- ^ Limongi, Roberto Murillo; Feijó, Eduardo Damous; Rodrigues Lopes E Silva, Marlos; Akaishi, Patrícia; Velasco E Cruz, Antônio Augusto; Christian Pieroni-Gonçalves, Allan; Pereira, Filipe; Devoto, Martin; Bernardini, Francesco; Marques, Victor; Tao, Jeremiah P. (February 2020). «Orbital Bone Decompression for Non-Thyroid Eye Disease Proptosis». Ophthalmic Plastic and Reconstructive Surgery. 36 (1): 13–16. doi:10.1097/IOP.0000000000001435. ISSN 1537-2677. PMID 31373985. S2CID 199388425.
- ^ «Graves Disease: Overview, Causes, and Symptoms». Healthline. Retrieved 2020-06-08.
- ^ Roy A, Dutta D, Ghosh S, Mukhopadhyay P, Mukhopadhyay S, Chowdhury S (2015). «Efficacy and safety of low dose oral prednisolone as compared to pulse intravenous methylprednisolone in managing moderate severe Graves’ orbitopathy: A randomized controlled trial». Indian Journal of Endocrinology and Metabolism. 19 (3): 351–8. doi:10.4103/2230-8210.152770. PMC 4366772. PMID 25932389.
- ^ a b contributors, ed. Kenneth L. Becker… With 330 (2001). Principles and Practice of Endocrinology and Metabolism (3 ed.). Philadelphia, Pa. [u.a.]: Lippincott, Williams & Wilkins. p. 636. ISBN 9780781717502. Archived from the original on 2017-09-08.
- ^ Carlé, Allan; Pedersen, Inge Bülow; Knudsen, Nils; Perrild, Hans; Ovesen, Lars; Rasmussen, Lone Banke; Laurberg, Peter (2011). «Epidemiology of subtypes of hyperthyroidism in Denmark: a population-based study». European Journal of Endocrinology. 164 (5): 801–809. doi:10.1530/EJE-10-1155. ISSN 0804-4643. PMID 21357288.
- ^ Pokhrel, Binod; Bhusal, Kamal (2020), «Graves Disease», StatPearls, Treasure Island (FL): StatPearls Publishing, PMID 28846288, retrieved 2020-12-04
- ^ Mathew Graves at Who Named It?
- ^ Graves, RJ. Newly observed affection of the thyroid gland in females Archived 2016-03-31 at the Wayback Machine. (Clinical lectures.) London Medical and Surgical Journal (Renshaw), 1835; 7 (part 2): 516–517. Reprinted in Medical Classics, 1940;5:33–36.
- ^ Von Basedow, KA. Exophthalmus durch Hypertrophie des Zellgewebes in der Augenhöhle. [Casper’s] Wochenschrift für die gesammte Heilkunde, Berlin, 1840, 6: 197–204; 220–228. Partial English translation in: Ralph Hermon Major (1884–1970): Classic Descriptions of Disease. Springfield, C. C. Thomas, 1932. 2nd edition, 1939; 3rd edition, 1945.
- ^ Von Basedow, KA. «Die Glotzaugen». [Casper’s] Wochenschrift für die gesammte Heilkunde, Berlin, 1848: 769–777.
- ^ a b c d e f g Basedow syndrome or disease at Who Named It? – the history and naming of the disease
- ^ a b c d Robinson, Victor, ed. (1939). «Exophthalmic goiter, Basedow disease, Grave disesase». The Modern Home Physician, A New Encyclopedia of Medical Knowledge. WM. H. Wise & Company (New York)., pages 82, 294, and 295.
- ^ Goiter, Diffuse Toxic at eMedicine
- ^ Flajani, G. Sopra un tumor freddo nell’anterior parte del collo broncocele. (Osservazione LXVII). In Collezione d’osservazioni e reflessioni di chirurgia. Rome, Michele A Ripa Presso Lino Contedini, 1802;3:270–273.
- ^ Testa, AG. Delle malattie del cuore, loro cagioni, specie, segni e cura. Bologna, 1810. 2nd edition in 3 volumes, Florence, 1823; Milano 1831; German translation, Halle, 1813.
- ^ Giuseppe Flajani at Who Named It?
- ^ Parry CH (1825). «Enlargement of the thyroid gland in connection with enlargement or palpitations of the heart». Collections from the unpublished medical writings of C. H. Parry. London. pp. 111–129.
According to Garrison, Parry first noted the condition in 1786. He briefly reported it in his Elements of Pathology and Therapeutics, 1815. Reprinted in Medical Classics, 1940, 5: 8–30
- ^ Hull G (June 1998). «Caleb Hillier Parry 1755-1822: a notable provincial physician». Journal of the Royal Society of Medicine. 91 (6): 335–8. doi:10.1177/014107689809100618. PMC 1296785. PMID 9771526.
- ^ Caleb Hillier Parry at Who Named It?
- ^ Sayyid Ismail Al-Jurjani. Thesaurus of the Shah of Khwarazm.
- ^ Ljunggren JG (August 1983). «[Who was the man behind the syndrome: Ismail al-Jurjani, Testa, Flagani, Parry, Graves or Basedow? Use the term hyperthyreosis instead]». Läkartidningen. 80 (32–33): 2902. PMID 6355710.
- ^ «水嶋ヒロ・絢香、2ショット会見で結婚報告 絢香はバセドウ病を告白、年内で休業へ» (in Japanese). Oricon. April 3, 2009. Archived from the original on December 8, 2015. Retrieved November 19, 2015.
- ^ «絢香、初のセルフ・プロデュース・アルバムが発売決定!» (in Japanese). CDJournal. December 1, 2011. Archived from the original on October 15, 2015. Retrieved November 19, 2015.
- ^ Shepley, Carol Ferring (2008). Movers and Shakers, Scalawags and Suffragettes: Tales from Bellefontaine Cemetery. St. Louis, Missouri: Missouri History Museum.
- ^ Altman LK (1991-05-28). «The Doctor’s World — A White House Puzzle: Immunity Ailments-Science Section». The New York Times. Archived from the original on 2013-05-08. Retrieved 2013-02-27.
- ^ Islam S (2017-01-23). «Thyroid gland – Hyperplasia / goiter – Graves disease». Pathologyoutlines.com. Archived from the original on 2016-12-14. Retrieved 2017-01-25.
- ^ Oldenburg A (2011-06-24). «Update: Missy Elliott ‘completely managing’ Graves’ disease». USA Today. Gannett.
- ^ «Famous People with Graves’ Disease». HRFnd. December 15, 2013. Retrieved 2018-02-22.
- ^ Kuhlenbeck M (June 29, 2016). «Marty Feldman versus the Suits». Jewish Currents. Retrieved 2018-02-22.
Viewers also could not help being amazed by his bulging eyes, which had resulted from a botched operation for Graves’ disease.
- ^ Rota G. «Facts About Sia Furler | Popsugar Celebrity Australia». Popsugar.com.au. Archived from the original on 2015-02-09. Retrieved 2016-09-10.
- ^ Guart, Al (March 31, 2002). «Rare Disease Could Whack Sammy Bull». New York Post. Archived from the original on January 11, 2012. Retrieved January 28, 2020.
- ^ «Hamilton talks about his disease on his podcast». YouTube. Archived from the original on 2017-09-08.
- ^ «Crossover Crooner: The Strange Comeback of Germany’s Wannabe Johnny Cash». Spiegel.de. 2013-02-07. Archived from the original on 2014-11-19. Retrieved 2014-07-27.
- ^ Spicer P (1998). Herbert Howells. Bridgend: Seren. p. 44. ISBN 1-85411-233-3.
- ^ «Yayoi Kusama by Grady T. Turner». Bomb Magazine. January 1, 1999. Retrieved May 29, 2020.
- ^ «Revolutionary First Lady: the life and struggles of Lenin’s wife». Russia Beyond. Archived from the original on 2018-04-18. Retrieved 2018-04-18.
- ^ «Barbara Leigh». Home.rmci.net. Archived from the original on 2012-07-10. Retrieved 2013-02-27.
- ^ «[歌手 増田恵子さん]バセドー病(1)マイク持つ手が震える». Yomiuri Shimbun. 2011-08-04. Retrieved 2020-02-01.
- ^ «[歌手 増田恵子さん]バセドー病(2)同じ病 姉の存在が支えに». Yomiuri Shimbun. 2011-08-11. Retrieved 2020-02-01.
- ^ «[歌手 増田恵子さん]バセドー病(3)ツアー中、甲状腺腫れ上がる». Yomiuri Shimbun. 2011-08-18. Retrieved 2020-02-01.
- ^ «[歌手 増田恵子さん]バセドー病(4)病気公表 無理せず我慢せず». Yomiuri Shimbun. 2011-08-25. Retrieved 2020-02-01.
- ^ «親子知新». www3.bigcosmic.com. Archived from the original on May 15, 2007. Retrieved December 18, 2017.
- ^ Rupert Murray «Meet the Climate Sceptics» Archived 2013-10-22 at the Wayback Machine, Storyville, 3 February 2011.
- ^ «Sophia Parnok, Russia’s Sappho».
- ^ Burgin, Diana Lewis (1992). «Sophia Parnok and the Writing of a Lesbian Poet’s Life». Slavic Review. 51 (2): 214–231. doi:10.2307/2499528. JSTOR 2499528. S2CID 163967264.
- ^ https://www.king.org/event/the-esoterics-parnok-in-that-infinite-moment/[permanent dead link]
- ^ Simon, Bernard (31 May 2013). «This memorial is poetic justice for Sir Cecil Spring Rice». telegraph.co.uk. Archived from the original on 2014-03-12. Retrieved 2014-08-25.
- ^ «Christina Rossetti». Poetry Foundation. Archived from the original on 2016-04-17. Retrieved 2016-09-10.
- ^ Wolf M (March 18, 1990). «There is Nothing Like This Dame». New York Times. Archived from the original on August 10, 2016. Retrieved 2015-10-19.
- ^ «Biography». Archived from the original on 2015-07-16. Retrieved 2015-07-16.
- ^ Melas C (February 21, 2018). «Wendy Williams announces show hiatus due to Graves’ disease». CNN. Retrieved February 21, 2018.
- ^ «Act Yasukawa Returns To Ring After Five Years Away». 15 November 2020.
- ^ Svevo, Italo (2003). Zeno’s conscience : a novel (1st Vintage International ed.). Vintage Books. pp. 315–321. ISBN 0375727760.
- ^ Scarponi, Mattia (19 August 2017). «Il morbo di Basedow: lo sfinimento tra Zeno e la realtà». theWise Magazine (in Italian). Retrieved 25 March 2020.
- ^ «Thyroid». Mayo Clinic. Archived from the original on 4 November 2016. Retrieved 1 November 2016.
External links[edit]
- «Graves’ disease». Genetics Home Reference. U.S. National Library of Medicine.
- https://www.ncbi.nlm.nih.gov/gene/?term=graves about graves on ncbi
Щитовидная железа – это относительно небольшой орган эндокринной системы, расположенный под кожей на передней поверхности шеи. Ее основная задача – выделение тиреоидных гормонов, регулирующих основной обмен (выделение энергии для жизнедеятельности клеток и тканей). Если в силу различных причин железа начинает работать активнее обычного, это может привести к Базедовой болезни у взрослых.
Это название традиционно осталось еще со времен советской медицины и на сегодняшний день считается устаревшим. В международной литературе и клинических рекомендациях используется название гипертиреоидизм или болезнь Грейвса (Graves Disease). Другие названия, которые используются в различных странах, включают такие синонимы:
- экзофтальмологический зоб;
- гипертиреоз Грейвса;
- болезнь Парри;
- токсический диффузный зоб.
Кроме того, существует еще и внутреннее подразделение болезни Грейвса в зависимости от преобладания тех или иных симптомов:
- дермопатия (когда особенно страдает кожа);
- остеопатия (проблемы скелета);
- офтальмопатия (преимущественно глазные симптомы).
Что такое Базедова болезнь
Базедова болезнь или тиреоидит Грейвса – это заболевание, поражающее щитовидную железу, а также кожу и глаза.
Щитовидная железа – это орган, который является частью эндокринной системы, целой сети эндокринных желез и тканей, которые выделяют гормоны, регулирующие химические процессы (метаболизм).
Гормоны влияют на жизнедеятельность организма, а также регулируют частоту сердечных сокращений, температуру тела и артериальное давление. Гормоны выделяются непосредственно в кровоток, откуда они попадают в различные области тела.
Базедова болезнь характеризуется аномальным увеличением щитовидной железы (так называемый зоб) и повышенной секрецией гормона щитовидной железы (гипертиреоз). Гормоны щитовидной железы задействованы во многих различных системах организма и, как следствие, специфические симптомы и признаки болезни Грейвса могут широко различаться среди людей разного пола и возраста. Общие симптомы включают непреднамеренную потерю веса, анормальную непереносимость тепла с сильной потливостью, мышечную слабость, утомляемость и выпячивание глазных яблок из орбит. Болезнь Грейвса по своей природе – это аутоиммунное заболевание.
Фото до и после Базедовой болезни
Причины Базедовой болезни у взрослых
Болезнь Грейвса считается аутоиммунным заболеванием, но ее развитию могут способствовать другие факторы, включая генетические, экологические или внешние. Аутоиммунные расстройства возникают, когда иммунная система организма по ошибке атакует здоровые ткани.
Иммунная система обычно производит специализированные белки, называемые антителами. Эти антитела реагируют на инородные материалы (например, бактерии, вирусы, токсины) в организме, вызывая их разрушение. Антитела могут напрямую убивать микроорганизмы или покрывать их, чтобы они легче разрушались лейкоцитами. Специфические антитела создаются в ответ на определенные материалы или вещества, стимулирующие выработку антител. Они называются антигенами.
При болезни Грейвса иммунная система вырабатывает аномальное антитело, называемое иммуноглобулином, стимулирующим щитовидную железу. Это антитело имитирует функцию нормального тиреотропного гормона (который выделяет гипофиз). Этот имитатор гормона прикрепляется к поверхности клеток щитовидной железы и заставляет клетки производить тиреоидные гормоны, что приводит к их избытку в крови. Возникает гиперактивность щитовидной железы, ее усиленная, избыточная работа. При офтальмопатии Грейвса эти антитела могут также влиять на клетки, окружающие глазное яблоко.
Больные люди могут иметь конкретные дефектные гены или генетическую предрасположенность к болезни Грейвса. Человек, который генетически предрасположен к заболеванию, несет ген (или гены) этого заболевания, но патология может не проявляться, если ген не запускается или не «активируется» при определенных обстоятельствах, например, из-за резко меняющихся факторов окружающей среды (так называемая многофакторная наследственность).
Были идентифицированы различные гены, которые связаны с болезнью Грейвса, включая те, которые:
- ослабляют или модифицируют ответ иммунной системы (иммуномодуляторы),
- которые напрямую связаны с функцией щитовидной железы, например, гены тиреоглобулина (Tg) или рецептора тиреотропного гормона (TSHR).
Ген Tg производит тиреоглобулин – белок, который содержится только в ткани щитовидной железы и играет роль в производстве ее гормонов.
Ген TSHR производит белок, который является рецептором и связывается со стимулирующим гормоном щитовидной железы. Точная основа взаимодействия генетических факторов и влияний окружающей среды, вызывающих болезнь Грейвса, до конца не изучена.
Дополнительные генетические факторы, известные как гены-модификаторы, могут играть роль в развитии или проявлении болезни. Факторы окружающей среды, которые могут спровоцировать развитие гипертиреоидита, включают экстремальный эмоциональный или физический стресс, инфекцию или беременность. Курящие люди подвергаются большему риску развития болезни Грейвса и офтальмопатии. Лица, у которых есть другие патологии, вызванные нарушением работы иммунной системы, такие как диабет 1-го типа или ревматоидный артрит, подвергаются большему риску развития болезни Грейвса.
У кого чаще бывает Базедова болезнь
Болезнь Грейвса поражает женщин чаще, чем мужчин, в соотношении 10:1. Заболевание обычно развивается в среднем возрасте с максимальной частотой в возрасте 40 — 60 лет, но также может поражать детей, подростков и пожилых людей. Болезнь Грейвса встречается практически в любой части мира. По оценкам, от нее страдают 2 — 3% населения. Кстати, именно Базедова болезнь – наиболее частая причина гипертиреоза.
Важны также другие проблемы со здоровьем и история семьи. Люди с болезнью Грейвса часто имеют в анамнезе других членов семьи с проблемами щитовидной железы или аутоиммунными заболеваниями. У некоторых родственников мог быть гипертиреоз или недостаточная активность щитовидной железы, у других могут быть другие аутоиммунные заболевания, включая преждевременное поседение волос (начиная с 20-летнего возраста). По аналогии, у пациента могут быть связанные иммунные проблемы в семье, включая ювенильный диабет, злокачественную анемию (из-за недостатка витамина B12) или безболезненные белые пятна на коже (витилиго).
Важно исключить другие причины гипертиреоза. Они включают токсический узловой или многоузловой зоб, который характеризуется одним или несколькими узелками либо шишками в щитовидной железе, которые постепенно растут и увеличивают свою активность, так что общий выход гормона щитовидной железы в кровь превышает норму.
Также, у людей могут временно появиться симптомы гипертиреоза, если у них есть состояние, называемое тиреоидитом. Это состояние вызвано проблемой с иммунной системой или вирусной инфекцией, которая заставляет железу пропускать накопленный гормон щитовидной железы. Типы тиреоидита включают подострый, тихий, инфекционный, индуцированный лучевой терапией и послеродовой тиреоидит.
В редких случаях определенные формы рака щитовидной железы и отдельные опухоли, такие как аденомы гипофиза, продуцирующие ТТГ, могут вызывать симптомы, подобные тем, которые наблюдаются при болезни Грейвса. Редко симптомы гипертиреоза также могут быть вызваны приемом слишком большого количества гормона щитовидной железы в форме таблеток.
Симптомы Базедовой болезни у взрослых
Симптомы, связанные с Базедовой болезнью, обычно появляются постепенно, иногда даже незаметно для самого человека (их могут первыми заметить родные). Для их развития требуется несколько недель или месяцев. Симптомы могут включать изменения поведения, например, резкую нервозность, раздражительность, тревожность, беспокойство и трудности со сном (бессонница). Дополнительные симптомы включают непреднамеренную потерю веса (без соблюдения строгих диет и изменений питания), мышечную слабость, аномальная непереносимость тепла, повышенное потоотделение, учащенное нерегулярное сердцебиение (тахикардия) и утомляемость.
Болезнь Грейвса часто связана с патологиями, поражающими глаза, которые часто называют офтальмопатией. Легкая форма офтальмопатии присутствует у большинства людей, страдающих гипертиреозом в какой-то момент болезни, менее 10% пациентов имеют значительное поражение глаз, которое требует активного лечения. Глазные симптомы могут развиваться до, одновременно или после развития гипертиреоза. В редких случаях у людей с глазными симптомами гипертиреоз никогда не развивается. В некоторых случаях поражение глаз может впервые проявиться или ухудшиться после лечения гипертиреоза.
Жалобы при офтальмопатии очень вариабельны. У некоторых людей они могут оставаться неизменными в течение многих лет, в то время как у других состояние может улучшаться или ухудшаться буквально за пару месяцев. Изменения также могут следовать по схеме: резкое ухудшение (обострение), а затем значительное улучшение (ремиссия). У большинства людей болезнь протекает в легкой форме без прогрессирования.
Общие проявления глазных симптомов – отек тканей, окружающих глазное яблоко, из-за чего оно может выпирать из орбиты, состояние, называемое проптозом (пучеглазием). Больные могут также отмечать сильную сухость глаз, припухлость век и их неполное смыкание, выворот век, воспаление, покраснение, боль и раздражение глаз. Некоторые люди описывают ощущение песка в глазах. Реже могут возникать нечеткость или двоение в глазах, чувствительность к свету или ухудшение зрения.
Очень редко у людей с болезнью Грейвса развивается поражение кожи, известное как претибиальная дермопатия или микседема. Это состояние характеризуется появлением утолщенной красноватой кожи на передней части голеней. Обычно оно ограничивается голенями, но иногда может возникать и на стопах. Редко возникает желеобразный отек тканей рук и припухлость пальцев рук и ног (акропахия).
Дополнительные симптомы, связанные с болезнью Грейвса, включают:
- учащенное сердцебиение;
- легкий тремор (дрожание) рук и / или пальцев;
- выпадение волос;
- ломкость ногтей;
- повышенные рефлексы (гиперрефлексию);
- усиленный аппетит и учащение дефекации.
У женщин с болезнью Грейвса могут наблюдаться изменения менструального цикла. У мужчин может наблюдаться эректильная дисфункция (импотенция).
В некоторых случаях болезнь Грейвса может прогрессировать, вызывая застойную сердечную недостаточность или аномальное истончение и слабость костей (остеопороз), что делает их хрупкими, из-за чего возникают переломы от незначительных травм или неловких движений.
Лечение Базедовой болезни у взрослых
Диагностика и лечение Базедовой болезни отражена в международных протоколах и национальных клинических рекомендациях. План обследования составляется в строгом соответствии с предполагаемым диагнозом и проводится поэтапно.
Диагностика
Диагноз болезни Грейвса ставится на основании подробного анамнеза пациента и его семьи (выясняют, есть ли у близких родственников проблемы аналогичного характера), тщательной клинической оценки, выявления характерных признаков и т.д. После того, как определены клинические симптомы, назначаются лабораторные тесты и инструментальные обледования.
Показаны общие анализы (крови, мочи, биохимия) и специализированные тесты, такие как анализы крови, которые измеряют уровни гормона щитовидной железы (Т3 и Т4) и гормона, стимулирующего щитовидную железу (уровень ТТГ). Для подтверждения диагноза могут быть выполнены анализы крови для выявления наличия специфических антител – к тиреоглоулину и тиоерпероксидазе, вызывающие болезнь Грейвса, но обычно в этом нет необходимости.
Современные методы лечения
Лечение болезни Грейвса обычно включает один из трех методов:
- антитиреоидные препараты (подавляют работу щитовидной железы по синтезу гормонов);
- использование радиоактивного йода;
- хирургическое вмешательство.
Конкретная рекомендуемая форма лечения может зависеть от возраста больного и степени болезни.
Клинические рекомендации
Все этапы лечения проводятся согласно рекомендациям по Клиническим протоколам
Наименее инвазивным методом лечения болезни Грейвса является использование препаратов, снижающих выброс гормона щитовидной железы (антитиреоидные препараты). Они особенно предпочтительны для лечения беременных женщин, лиц с легкими формами гипертиреоза или пациентов, которым требуется быстрое лечение гипертиреоза. Конкретные препараты подбирает врач, исходя из возраста пациента, его состояния и дополнительных факторов.
Окончательные методы лечения болезни Грейвса – это те, которые разрушают щитовидную железу, что приводит к гипотиреозу. Терапия радиоактивным йодом является наиболее распространенным методом лечения болезни Грейвса во многих странах. Йод – это химический элемент, используемый щитовидной железой для создания (синтеза) гормонов щитовидной железы. Почти весь йод в организме человека усваивается тканями щитовидной железы. Больные проглатывают раствор, содержащий радиоактивный йод, который будет перемещаться по кровотоку и накапливаться в щитовидной железе, где он повредит и разрушит ткань щитовидной железы. Это сократит щитовидную железу и снизит перепроизводство гормонов. Если уровень гормона щитовидной железы падает слишком низко, может потребоваться гормональная терапия для восстановления адекватного уровня тиреоидных гормонов.
Другой радикальной терапией является операция по удалению всей или части щитовидной железы (тиреоидэктомия). Этот метод лечения болезни обычно предназначен для людей, у которых другие формы лечения не принесли успеха или противопоказаны, или при наличии разрастания тканей железы до значительных размеров. После операции часто возникает гипотиреоз – это желаемый результат, который корректируют строго выверенной дозой гормонов извне.
В дополнение к трем вышеупомянутым методам лечения могут быть прописаны препараты, которые блокируют выполнение своих функций гормоном щитовидной железы, который уже циркулирует в крови (бета-блокаторы). Можно использовать бета-блокаторы, такие как пропранолол, атенолол или метопролол. Когда уровень гормонов щитовидной железы нормализуется, терапию бета-адреноблокаторами можно прекратить.
Во многих случаях необходимо наблюдение в течение всей жизни и лабораторные исследования. В некоторых случаях может потребоваться пожизненная заместительная гормональная терапия.
Легкие случаи офтальмопатии можно лечить с помощью солнцезащитных очков, мазей, искусственных слез. Более серьезные случаи можно лечить кортикостероидами, такими как преднизон, для уменьшения отека тканей, окружающих глаза.
В более тяжелых случаях также может потребоваться операция по орбитальной декомпрессии и орбитальная лучевая терапия. Во время операции по орбитальной декомпрессии хирург удаляет кость между глазницей (орбитой) и пазухами. Это позволяет глазу вернуться в свое естественное положение в глазнице. Эта операция обычно предназначена для людей, которые подвержены риску потери зрения из-за давления на зрительный нерв или у которых другие варианты лечения не сработали.
Профилактика Базедовой болезни у взрослых в домашних условиях
Предсказать заранее развитие болезни и предотвратить ее – сложно. Но есть меры для того, чтобы уменьшить риски осложнений и прогрессирования гипертиреоза.
Если выставлен диагноз Базедовой болезни, сделайте своим приоритетом психическое и физическое благополучие.
Правильное питание и упражнения могут улучшить проявления некоторых симптомов во время лечения и помогут в целом почувствовать себя лучше. Например, поскольку щитовидная железа контролирует метаболизм, после коррекции гипертиреоза может появиться склонность к полноте и хрупкости костей, а упражнения с отягощением могут помочь сохранить плотность костей и вес.
Снижение стресса может быть полезным, так как он может вызвать или усугубить болезнь Грейвса. Приятная музыка, теплая ванна или прогулка помогут расслабиться и улучшить настроение.
Отказ от вредных привычек – не курите. Курение ухудшает офтальмопатию Грейвса. Если болезнь поражает вашу кожу (дермопатия), используйте безрецептурные кремы или мази, содержащие гидрокортизон, для снятия отека и покраснения. Кроме того, может помочь компрессионное обертывание ног.
Популярные вопросы и ответы
Вопросы, касающиеся Базедовой болезни, мы обсудили с врачом-терапевтом, эндоскопистом, заведующей организационно-методическим кабинетом Лидией Голубенко.
Чем опасна Базедова болезнь?
Если у вас сверхактивная щитовидная железа (гипертиреоз), могут развиться некоторые осложнения, особенно если это состояние не лечить.
Проблемы со зрением, известные как заболевание щитовидной железы или офтальмопатия Грейвса, затрагивают примерно 1 из 3 человек с повышенной активностью щитовидной железы, вызванной Базедовой болезнью. Проблемы могут включать:
● ощущение сухости и песка в глазах;
● резкую чувствительность к свету;
● слезотечение;
● нечеткое зрение или двоение в глазах;
● красноту глаз;
● пучеглазие.
Многие случаи протекают в легкой форме и улучшаются по мере лечения щитовидной железы, но примерно в 1 из 20 — 30 случаев есть риск потери зрения.
Лечение сверхактивной щитовидной железы часто приводит к слишком низкому уровню гормонов. Это называется недостаточной активностью щитовидной железы (гипотиреоз). Симптомы недостаточной активности щитовидной железы могут включать:
● чувствительность к холоду;
● усталость;
● увеличение веса;
● запор;
● депрессия.
Снижение активности щитовидной железы иногда бывает временным, но часто нужно постоянное и долгосрочное лечение гормональными препаратами щитовидной железы.
У женщин возможны проблемы с беременностью. Если щитовидная железа слишком активна во время беременности и ваше состояние плохо контролируется, это может увеличить риск:
● преэклампсии;
● выкидыша;
● преждевременных родов (до 37 недели беременности);
● у вашего ребенка может быть низкий вес при рождении.
Если вы не планируете беременность, важно использовать противозачаточные средства, потому что некоторые методы лечения Базедовой болезни могут нанести вред нерожденному ребенку.
Какие могут быть осложнения при Базедовой болезни?
В редких случаях недиагностированный или плохо контролируемый гипертиреоз может привести к серьезному, опасному для жизни состоянию, называемому тиреоидным кризом. Это внезапное обострение симптомов, которое может быть вызвано:
● инфекцией;
● наступлением беременности;
● неправильным приемом лекарств;
● повреждением щитовидной железы, например при ударе по горлу.
Симптомы тиреоидного криза включают:
● учащенное сердцебиение;
● высокую температуру;
● понос и тошноту;
● пожелтение кожи и глаз (желтуха);
● сильное возбуждение и спутанность сознания;
● потерю сознания и кому.
Сверхактивная щитовидная железа также может увеличить ваши шансы на развитие:
● фибрилляции предсердий – поражения сердца, которые вызывают нерегулярную и часто аномально высокую частоту сердечных сокращений;
● разрешение костей (остеопороз) – состояние, при котором ваши кости становятся хрупкими и с большей вероятностью могут сломаться;
● сердечная недостаточность – сердце не может правильно перекачивать кровь по телу.
Когда вызывать врача на дом при Базедовой болезни?
Появление любых необычных симптомов или проявлений, описанных выше, должно стать поводом для немедленной консультации с врачом, в том числе – на дому.
ММА имени И.М. Сеченова
Болезнь Грейвса (болезнь Базедова, диффузный токсический зоб, БГ) – системное аутоиммунное заболевание, развивающееся вследствие выработки антител к рецептору тиреоторопного гормона (ТТГ), клинически проявляющееся поражением щитовидной железы (ЩЖ) с развитием синдрома тиреотоксикоза в сочетании с экстратиреоидной патологией (эндокринная офтальмопатия, претибиальная микседема, акропатия). Одновременное сочетание всех компонентов системного аутоиммунного процесса встречается относительно редко и не является облигатным для постановки диагноза. В большинстве случаев наибольшее клиническое значение при БГ имеет поражение ЩЖ.
В США и Англии частота новых случаев БГ варьирует от 30 до 200 случае на 100 тысяч населения в год. Женщины заболевают БГ в 10–20 раз чаще. В регионах с нормальным йодным обеспечением болезнь Грейвса является наиболее частой причиной стойкого тиреотоксикоза, а в йододефицитных регионах в этиологической структуре токсического зоба БГ конкурирует с функциональной автономией ЩЖ (узловой и многоузловой токсический зоб). В России в качестве синонима термина болезнь Грейвса (болезнь Базедова) традиционно используется термин диффузный токсический зоб, который не лишен ряда существенных недостатков. Во–первых, он характеризует лишь макроскопическое (диффузный зоб) и функциональное (токсический) изменение ЩЖ, которое не является облигатным для болезни Грейвса: с одной стороны, увеличения железы может не быть, с другой – он может быть не диффузным. Вместе с тем, диффузное увеличение ЩЖ в сочетании с тиреотоксикозом может иметь место при других заболеваниях, в частности, при так называемой диффузной функциональной автономии. Использование более широкого термина «болезнь» (а не просто токсический зоб) применительно к обсуждаемому заболеванию, скорее всего, более оправдано, поскольку он в большей мере подчеркивает системность аутоиммунного процесса. Кроме того, во всем мире традиционно наиболее часто используется и, таким образом, узнается именно термин болезнь Грейвса, а в немецко–говорящих странах – болезнь Базедова.
Патогенез
БГ является мультифакториальным заболеванием, при котором генетические особенности иммунного реагирования реализуются на фоне действия факторов окружающей среды. Наряду с этнически ассоциированной генетической предрасположенностью (носительство гаплотипов HLA–B8, –DR3 и –DQA1*0501 у европейцев) в патогенезе БГ определенное значение придается психосоциальным и средовым факторам. Так, уже достаточно давно обсуждается значение инфекционных и стрессорных факторов, в частности, ряд работ выдвигает теорию «молекулярной мимикрии» между антигенами ЩЖ, ретробульбарной клетчатки и рядом стресс–протеинов и антигенов бактерий (Yersinia enterocolitica). Эмоциональные стрессорные и экзогенные факторы, такие как курение, могут способствовать реализации генетической предрасположенности к БГ. Так, была обнаружена временная взаимосвязь между манифестацией БГ и потерей супруга (партнера). Курение повышает риск развития БГ в 1,9 раз.
БГ в ряде случаев сочетается с другими аутоиммунными эндокринными заболеваниями (сахарный диабет 1 типа, первичный гипокортицизм); такое сочетание принято обозначать, как аутоиммунный полигландулярный синдром II типа.
В результате нарушения иммунологической толерантности, аутореактивные лимфоциты (CD4+ – и CD8+ –T–лимфоциты, B–лимфоциты) опосредованно адгезивными молекулами (ICAM–1, ICAM–2, E–селектин, VCAM–1, LFA–1, LFA–3, CD44) инфильтрируют паренхиму ЩЖ, где распознают ряд антигенов, которые презентируются дендридными клетками, макрофагами, В–лимфоцитами и HLA–DR–экспримирующими фолликулярными клеткам. В дальнейшем цитокины и сигнальные молекулы инициируют антигенспецифическую стимуляцию В–лимфоцитов, в результате чего начинается продукция специфических иммуноглобулинов против различных компонентов тироцитов. В патогенезе БГ основное значение придается образованию стимулирующих антител к рецептору ТТГ (АТ–рТТГ). Эти антитела связываются с рецептором ТТГ, приводят его в активное состояние, запуская внутриклеточные системы (каскады цАМФ и фосфоинозитолов), которые стимулируют захват ЩЖ йода, синтез и высвобождение тиреоидных гормонов, а также пролиферацию тироцитов. В результате развивается синдром тиреотоксикоза, доминирующий в клинической картине БГ.
Клиническая картина
Классическая мерзебургская триада (зоб, тахикардия, экзофтальм), описанная еще Карлом Базедовым, встречается примерно у 50% пациентов. Примерно в 2/3 случаев БГ развивается в возрасте после 30 лет, не менее, чем в 5 раз чаще – у женщин. В отдельных популяциях (Япония, Швеция) БГ почти в половине случаев манифестирует на протяжении первого года после родов.
Как указывалось, клиническая картина БГ определяется синдромом тиреотоксикоза, для которого характерны: похудение (часто на фоне повышенного аппетита), потливость, тахикардия и ощущение сердцебиения, внутреннее беспокойство, нервозность, дрожь рук (а порой, всего тела), общая и мышечная слабость, быстрая утомляемость и ряд других симптомов, подробно описанных в литературе. В отличие от многоузлового токсического зоба, который связан с функциональной автономией ЩЖ, при БГ, как правило, имеет место короткий анамнез: симптомы развиваются и прогрессируют быстро и в большинстве случаев приводят пациента к врачу в пределах 6–12 месяцев. У пожилых пациентов тиреотоксикоз любого генеза часто протекает олиго– или моносимптомно (вечерний субфебрилитет, аритмии) или даже атипично (анорексия, неврологическая симптоматика). При пальпаторном исследовании примерно у 80% пациентов удается выявить увеличение ЩЖ, порой весьма значительное: пальпаторно железа плотноватая, безболезненная.
В ряде случаев, при БГ на первое место могут выходить проявления эндокринной офтальмопатии (выраженный экзофтальм, нередко имеющий несимметричный характер, диплопия при взгляде в одну из сторон или вверх, слезотечение, ощущение «песка в глазах», отечность век). Здесь следует оговориться, что наличие у пациента выраженной эндокринной офтальмопатии (ЭОП) позволяет практически безошибочно установить пациенту этиологический диагноз уже по клинической картине, поскольку среди заболеваний, протекающих с тиреотоксикозом, ЭОП сочетается только с БГ.
Диагностика
Диагностика в типичных случаях не вызывает существенных трудностей (табл. 1). При подозрении на наличие у пациента тиреотоксикоза ему показано определение уровня ТТГ высокочувствительным методом (функциональная чувствительность не менее 0,01 мЕд/л). При обнаружении пониженного уровня ТТГ пациенту проводится определение уровня свободных Т4 и Т3: если хотя бы один из них повышен – речь идет о манифестном тиреотоксикоза, если они оба в норме – о субклиническом.
После подтверждения наличия у пациента тиреотоксикоза проводится этиологическая диагностика, направленная на выявление конкретного заболевания, которое его обусловило. При УЗИ примерно в 80% случаев БГ обнаруживается диффузное увеличение ЩЖ; кроме того, этот метод может выявить характерную для большинства аутоиммунных заболевания гипоэхогенность ЩЖ. По данным сцинтиграфии при БГ выявляется диффузное усиление захвата изотопа железой. Как и при всех других аутоиммунных заболеваниях ЩЖ, при БГ могут определяться высокие уровни классических антител к ЩЖ (антитела к тиреоидной пероксидазе – АТ–ТПО и антитела к тиреоглобулину – АТ–ТГ). Это наблюдается не менее чем в 70–80% случаев БГ. Таким образом, обнаружение классических антител не позволяет отличить БГ от хронического аутоиммунного, послеродового и «безболевого» («молчащего») тиреоидита, но может, в сумме с другими признаками, существенно помочь в дифференциальной диагностике БГ и функциональной автономии ЩЖ. Следует помнить о том, что классические антитела могут обнаруживаться у здоровых людей без каких–либо заболеваний ЩЖ. Большее диагностическое значение имеет определение уровня антител к рецептору ТТГ (АТ–рТТГ), которое, увы, пока не абсолютно из–за несовершенства имеющихся тестсистем. В таблице 2 представлена краткая характеристика других заболеваний, протекающих с тиреотоксикозом, с которыми необходимо дифференцировать БГ.
Лечение
Прежде всего, планируя лечение, нужно отчетливо понимать, что при БГ речь идет об аутоиммунном заболевании, причиной которого является выработка антител к ЩЖ иммунной системой. Вопреки этому, к сожалению, очень часто приходится сталкиваться с представлением о том, что хирургическое удаление части ЩЖ само по себе способно вызвать ремиссию заболевания (т.е., по сути, аутоиммунного процесса), хотя как хирургия БГ, так и терапия радиоактивным йодом–131 идеологически должна восприниматься, лишь как удаление из организма «органа–мишени» для антител, ликвидирующее тиреотоксикоз. В настоящее время существует 3 метода лечения БГ, каждый из которых не лишен существенных недостатков.
Прежде всего, планируя лечение, нужно отчетливо понимать, что при БГ речь идет об аутоиммунном заболевании, причиной которого является выработка антител к ЩЖ иммунной системой. Вопреки этому, к сожалению, очень часто приходится сталкиваться с представлением о том, что хирургическое удаление части ЩЖ само по себе способно вызвать ремиссию заболевания (т.е., по сути, аутоиммунного процесса), хотя как хирургия БГ, так и терапия радиоактивным йодом–131 идеологически должна восприниматься, лишь как удаление из организма «органа–мишени» для антител, ликвидирующее тиреотоксикоз. В настоящее время существует 3 метода лечения БГ, каждый из которых не лишен существенных недостатков.
Консервативное лечение болезни Грейвса
Назначается для достижения эутиреоза перед оперативным лечением, а также в отдельных группах пациентов в качестве базового длительного курса лечения, который в некоторых случаях приводит к стойкой ремиссии. Длительную консервативную терапию имеет смысл планировать далеко не у всех пациентов. В первую очередь, речь идет о пациентах с умеренным увеличением объема ЩЖ (до 40 мл); при зобе больших размеров после отмены тиреостатиков неминуемо разовьется тиреотоксикоз. Кроме того, консервативную терапию нецелесообразно планировать у пациентов с крупными (более 1–1,5 см) узловыми образованиями в ЩЖ и при наличии выраженных осложнений тиреотоксикоза (мерцательная аритмия, выраженный остеопороз и др.). Практически бессмысленно (и главное – небезопасно для пациента) назначение повторных курсов лечения при развитии рецидива тиреотоксикоза спустя 12–24 месяца тиреостатической терапии. Важным условием планирования длительной тиростатической терапии является готовность пациента следовать рекомендациям врача (комплаентность) и доступность квалифицированной эндокринологической помощи.
В качестве основных тиреостатиков на протяжении многих десятилетий в клинической практике во всем мире используются препараты из группы тионамидов: тиамазол (Метизол) и пропилтиоурацил. Ключевой механизм действия тионамидов заключается в том, что, попадая в ЩЖ, они подавляют действие тиреоидной пероксидазы, ингибируют окисление йода, йодирование тиреоглобулина и конденсацию йодтирозинов. В результате прекращается синтез тиреоидных гормонов и купируется тиреотоксикоз. Наряду с этим выдвигается не всеми поддерживаемая гипотеза о том, что тионамиды, в первую очередь, тиамазол, обладают эффектами на иммунологические изменения, развивающиеся при БГ. В частности, предполагается, что тионамиды влияют на активность и количество некоторых субпопуляций лимфоцитов, снижают иммуногенность тиреоглобулина за счет уменьшения его йодирования, снижают продукцию простагландинов Е2, IL–1, IL–6 и продукцию тироцитами белков теплового шока. Именно с этим связывается тот факт, что в правильно отобранной группе пациентов с БГ, на фоне подержания тионамидами эутироза в течение 12–24 месяцев примерно в 30% случаев можно ожидать развития стойкой ремиссии заболевания.
Если пациенту планируется проведение курса тиростатической терапии, тионамиды в начале назначаются в относительно больших дозах: 30–40 мг тиамазола (на 2 приема) или пропилтиоурацила – 300 мг (на 3–4 приема). На фоне такой терапии спустя 4–6 недель у 90% пациентов с тиреотоксикозом средней тяжести удается достичь эутиреоидного состояния, первым признаком которого является нормализация уровня свободного Т4. Уровень ТТГ может еще долго оставаться сниженным. На период до достижения эутиреоза (зачастую и на более длительный срок) большинству пациентов целесообразно назначение b-адреноблокаторов (пропранолол – 120 мг/сут на 3–4 приема или длительнодействующие препараты, например, атенолол – 100 мг/сут однократно). От «увлечения» малыми стартовыми дозами тиамазола, когда исходно предлагалось назначать 10–15 мг препарата в день, в последнее десятилетие большинство руководств отошли, поскольку при таком варианте терапии достижение эутиреоза растягивается на слишком большой промежуток времени, что клинически не выгодно, зачастую небезопасно и не исключает риска лейкопенических реакций. В то же время от небезопасного назначения мегадоз тиамазола в качестве стартовой терапии (80–120 мг) также отошли за исключением случаев тяжелейшего тиреотоксикоза.
После нормализации уровня свободного Т4 пациенту начинают снижать дозу тиреостатика и примерно через 2–3 недели переходят на прием поддерживающей дозы (10–15 мг в день). Параллельно, начиная от момента нормализации уровня Т4 или несколько позже, пациенту назначается левотироксин в дозе 50–100 мкг в день. Такая схема получила название «блокируй и замещай»: один препарат блокирует железу, другой замещает формирующийся дефицит тиреоидных гормонов. Схема «блокируй и замещай» проста в использовании, поскольку позволяет полностью заблокировать продукцию тиреоидных гормонов, что исключает возможность возвращений тиреотоксикоза. Критерием адекватности терапии является стойкое поддержание нормального уровня Т4 и ТТГ (последний может приходить в норму на протяжении нескольких месяцев от начала лечения). Вопреки бытующим представлениям тиамазол и пропилтиоурацил сами по себе не обладают так называемым «зобогенным» эффектом. Увеличение размера ЩЖ на фоне их приема закономерно развивается лишь при развитии медикаментозного гипотиреоза, которого можно легко избежать, назначив левотироксин в рамках схемы «блокируй и замещай».
Поддерживающая терапия «блокируй и замещай» (10–15 мг тиамазола и 50–100 мкг левотироксина) продолжается от 12 до максимум 24 месяцев (табл. 1). Дальнейшее увеличение объема ЩЖ на фоне проводимой терапии даже при условии стойкого поддержания эутиреоза (это закономерно произойдет при медикаментозном гипотиреозе или, наоборот, при недостаточной блокаде ЩЖ) существенно снижает шансы на успех лечения. На протяжении всего лечения у пациента с интервалом не менее чем 1 раз в месяц необходимо проводить определение уровня лейкоцитов и тромбоцитов. Редким (0,06%), но грозным осложнением тионамидов (как тиамазола, так, с практически одинаковой частотой пропилтиоурацила) является агранулоцитоз, казуистически редко – изолированная тромбоцитопения. После окончания курса лечения препараты отменяются; наиболее часто рецидив развивается в течение первого года после прекращения терапии.
Оперативное лечение
По современным представлениям, целью оперативного лечения, равно как и обсуждаемой ниже терапии йодом–131, является удаление большей части ЩЖ, с одной стороны, обеспечивающее развитие послеоперационного гипотиреоза, а с другой (что наиболее принципиально) – исключающее любую возможность рецидива тиреотоксикоза. С этой целью рекомендуется проведение предельно субтотальной резекции ЩЖ с оставлением тиреоидного остатка не более 2–3 мл. Проведение субтотальных резекций, с одной стороны, несет высокий риск сохранения или отдаленного рецидива тиреотоксикоза, а с другой, отнюдь не исключает развития гипотиреоза. При выполнении так называемых «экономных резекций», объем которых во всем мире расцениваются, как неадекватный, следует понимать, что оставляя во время операции достаточную для продукции тиреоидных гормонов часть ЩЖ, в организме, по сути дела, остается «мишень» для антитиреоидных антител, продуцирующихся клетками иммунной системы.
Таким образом, полеоперационный гипотиреоз в настоящее время перестал рассматриваться, как осложнение оперативного лечения БГ, и является его целью. Предпосылкой для этого стало внедрение в широкую клиническую практику современных препаратов левотироксина, на фоне адекватного приема которых у пациента сохраняется стойкий эутиреоз и качество жизни, не отличающееся от обычного. На сегодняшний день можно без преувеличения сказать, что не существует такого гипотиреоза, компенсация которого при грамотном использовании современных препаратов тиреоидных гормонов была бы невозможна. Неудачи в лечении послеоперационного и любого другого гипотиреоза следует искать либо в недостаточной квалификации проводящего заместительную терапию, либо в несоблюдении пациентом достаточно простых рекомендаций по приему препарата.
Терапия радиоактивным йодом
Можно без преувеличения сказать, что во всем мире большая часть пациентов с БГ, равно как и с другими формами токсического зоба, в качестве лечения получает именно терапию радиоактивным йодом–131. Это связано с тем, что метод эффективен, неинвазивен, относительно дешев, лишен тех осложнений, которые могут развиться во время операции на ЩЖ. Единственными противопоказаниями к лечению йодом–131 являются беременность и грудное вскармливание.
Если в нашей стране по сей день продолжает бытовать мнение о том, что терапия йодом–131 показана лишь пожилым пациентам, которым по тем или иным причинам невозможно провести операцию, то на самом деле, уже не существует нижней возрастной границы для назначения йода–131, и во многих странах йод–131 с успехом используется для лечения БГ у детей. Было доказано, что независимо от возраста риск терапии йодом–131 существенно ниже такового при оперативном лечении.
В значимых количествах йод–131 накапливается только в ЩЖ; после попадания в нее, он начинает распадаться с выделением b-частиц, которые имеют длину пробега около 1–1,5 мм, что обеспечивает локальную лучевую деструкцию тироцитов. Безопасность этого метода лечения демонстрирует тот факт, что в ряде стран, например, в США, где 99% пациентов с БГ получают йод–131 в качестве лечения первого выбора, терапия йодом–131 при БГ осуществляется в амбулаторном порядке. Существенное преимущество заключается в том, что лечение йодом–131 можно проводить без предварительной подготовки тионамидами. При болезни БГ, когда целью лечения является разрушение ЩЖ, терапевтическая активность, с учетом объема ЩЖ, максимального захвата и времени полувыведения йода–131 из ЩЖ, рассчитывается исходя из предполагаемой поглощенной дозы в 200–300 Гр. Гипотиреоз обычно развивается в течение 6 месяцев после введения йода–131.
Серьезной проблемой отечественной эндокринологии является фактическое отсутствие в распоряжении эндокринологов такого прекрасного способа лечения БГ, как терапия йодом–131.
Заключение
БГ является одним из самых частых аутоиммунных заболеваний человека. Его клиническая картина и прогноз в большинстве случаев определяются стойким тиреотоксикозом, который при отсутствии адекватного лечения может привести к тяжелой инвалидизации пациента. Существующие на сегодняшний день принципы лечения БГ, хотя и не лишены недостатков, но позволяют полностью избавить пациента от тиреотоксикоза и обеспечить приемлемое качество жизни.